Книга: Вопрос жизни [Энергия, эволюция и происхождение сложности]
Глава 5 Появление сложных клеток
| <<< Назад Часть III О сложности |
Вперед >>> Глава 6 Половое размножение и происхождение смерти |
Разделы на этой странице:
Глава 5
Появление сложных клеток
Герой Орсона Уэллса в фильме-нуар “Третий человек” (1949) произнес знаменитую фразу: “При герцогах Борджиа в Италии тридцать лет бушевала война, совершались убийства и кровопролития, но Италия подарила миру Микеланджело, Леонардо да Винчи и Ренессанс. В Швейцарии же пятьсот лет процветали братская любовь, мир и демократия – и что дала миру она? Часы с кукушкой!” Говорят, эту фразу придумал сам Уэллс. Вскоре после выхода фильма в прокат он получил сердитое послание от правительства Швейцарии: “Мы не занимаемся производством часов с кукушкой!” Я не имею ничего ни против Швейцарии, ни против Орсона Уэллса – просто эта фраза хорошо описывает эволюцию. С тех пор, как 1,5-2 млрд лет назад появились сложные эукариотические клетки, мы наблюдаем войны, террор, кровопролитие: оскал природы во всей его ужасающей красе. Но прежде было целых 2 млрд лет, на протяжении которых царили мир, симбиоз и бактериальная любовь (не только платоническая) – но что прокариоты смогли предложить миру? По своей величине и сложности внешнего строения им далеко даже до часов с кукушкой. В отношении морфологической сложности ни бактерии, ни археи не сравнимы даже с одноклеточными эукариотами.
Внутри двух огромных доменов прокариот – бактерий и архей – наблюдается грандиозное генетическое и биохимическое разнообразие. В отношении метаболизма прокариоты кладут эукариот на лопатки: одна-единственная бактерия может похвастаться таким метаболическим разнообразием, какое не наберется и по всему эукариотическому домену. Но по какой-то причине ни бактерии, ни археи не достигли того уровня структурной сложности, который хоть сколько-нибудь приближен к эукариотическому. Клетки прокариот, как правило, в 15 тыс. раз мельче эукариотических (хотя есть выдающиеся исключения, которые мы рассмотрим). Хотя размеры геномов прокариот и эукариот могут совпадать, самый большой бактериальный геном содержит примерно 12 млн пар оснований ДНК. (В геноме человека примерно 3 тыс. млн пар оснований, а некоторые эукариотические геномы достигают 100 тыс. млн пар оснований или даже больше.) Удивительно, что за 4 млрд лет бактерии и археи едва ли изменились. Земля за это время пережила грандиозные перемены. Повышение концентрации кислорода в воздухе и водах океана изменило условия жизни, но бактерии остались неизменными. Периоды глобального оледенения (“Земля-снежок”) должны были поставить экосистемы на грань вымирания – но бактерии остались неизменными. “Кембрийский взрыв” вызвал к жизни множество форм: “испытательных площадок”, на которых прокариотам предстояло опробовать свои орудия. Говоря о бактериях, в первую очередь мы вспоминаем патогены, хотя болезнетворные агенты – лишь верхушка прокариотического айсберга. Но, несмотря на глобальные экологические сдвиги, бактерии остаются решительно верными бактериальной сути. Никогда они не породили ничего настолько крупного и сложно устроенного, как, например, блоха. Бактерии – самые консервативные на свете существа.
В гл. 1 я утверждал, что эти факты лучше объясняются с позиции структурных ограничений[67]. В физическом строении эукариот есть нечто такое, что радикально отличает их и от бактерий, и от архей. Преодолев это структурное ограничение, эукариоты обрели возможность исследовать мир морфологической сложности, и это удалось лишь им. Прокариоты, исследуя возможности метаболизма, находили остроумные решения сложнейших химических задач. А эукариоты, забросив развитие своего “химического интеллекта”, занялись изучением возможностей, которые предоставляют крупный размер и более высокая степень структурной сложности.
Нет ничего удивительного в идее, что существует некий барьер, не позволяющий прокариотам достигнуть эукариотической сложности. Но что представляет собой этот барьер, мнения расходятся. Предлагались разные варианты: от потери клеточной стенки (которая должна обернуться катастрофой для прокариот) до приобретения линейных хромосом. Исчезновение клеточной стенки действительно может стать катастрофой, поскольку без этого жесткого внешнего каркаса клетки быстро набухают и лопаются. Однако эта “смирительная рубашка” физически не позволяет клеткам изменять свою форму, ползать и заглатывать другие клетки путем фагоцитоза. В тех редких случаях, когда потеря клеточной стенки проходила удачно, это открывало возможности для возникновения фагоцитоза. Оксфордский биолог Томас Кавалье-Смит уже долгое время доказывает, что приобретение фагоцитоза – это ключевое событие в эволюции эукариот. Действительно, потеря клеточной стенки необходима для фагоцитоза. Но многие бактерии утратили клеточную стенку, и это не закончилось катастрофой: так называемые бактерии L-формы превосходно себя чувствуют без клеточной стенки, однако не выказывают ни намека на возникновение фагоцитоза. У некоторых архей также нет клеточной стенки, но и они не начинают фагоцитировать. Идея, что громоздкая клеточная стенка послужила главным, тем самым ограничением, которое не позволило ни бактериям, ни археям достичь большей сложности, едва ли выдерживает критику. Ей противоречит тот факт, что многие бактерии и археи, утратив клеточную стенку, не стали сложнее, тогда как многие эукариоты, включая грибы и растения, имеют клеточные стенки (хотя и отличные от прокариотических) и, несмотря на это, устроены гораздо сложнее прокариотов. Показательный пример – эукариотические водоросли в сравнении с цианобактериями. Их образ жизни примерно совпадает – и те, и другие живут за счет фотосинтеза и имеют клеточную стенку, но геномы водорослей, как правило, на несколько порядков больше, что позволяет клеткам водорослей достигать гораздо более крупных размеров и высокой структурной сложности.
С линейными хромосомами та же проблема. Прокариотические хромосомы обычно кольцевые, и репликация ДНК начинается в определенной точке кольца (репликон). Однако репликация ДНК часто происходит медленнее, чем клеточное деление, и клетка не сможет поделиться надвое до тех пор, пока ее ДНК не будет полностью скопирована. Это означает, что наличие одного репликона ограничивает максимальный размер бактериальной хромосомы, потому что клетки с хромосомами меньшего размера будут осуществлять репликацию и делиться быстрее, чем клетки, чьи хромосомы длиннее. Если клетка потеряет какие-либо ненужные гены, она сможет делиться быстрее. В итоге бактерии с маленькими хромосомами должны стать преобладающей в популяции формой, особенно если у них есть возможность приобретать путем горизонтального переноса гены, потерянные ранее и вновь ставшие нужными. У эукариот все иначе: обычно у них много линейных хромосом, и каждая содержит много репликонов. Это значит, что у эукариот репликация ДНК идет параллельно, а у бактерий – последовательно. Но и это ограничение вряд ли может объяснить, почему прокариоты не выработали многочисленные линейные хромосомы. Действительно: оказывается, некоторые современные бактерии и археи имеют линейные хромосомы и “параллельную” репликацию, но при этом не увеличили размер своих геномов, подобно эукариотам. Их должно останавливать что-либо другое.
Почти все предлагаемые варианты ограничений, не позволяющих бактериям приобрести эукариотическую сложность, вызывают сомнения по одной и той же причине: из каждого правила есть множество исключений. И поэтому, как с убийственной вежливостью говорил Джон Мейнард Смит, такие объяснения просто не годятся.
Что делать? Филогенетика не может дать простой и ясный ответ. Последний общий предок эукариот был сложной клеткой, у которой уже имелись линейные хромосомы, связанное с мембраной ядро, митохондрии, многочисленные специализированные “органеллы” и другие мембранные структуры, а также динамический цитоскелет и половое размножение. Это была вполне узнаваемая “современная” эукариотическая клетка. У бактерий нет ни одного из этих свойств в том виде, который хоть немного напоминал бы эукариотическое состояние. Некий филогенетический “горизонт событий” не позволяет нам узнать, как до Всеобщего предка протекала эволюция эукариотических черт. Вообразите, например, что эукариотические черты – это атрибуты современного общества (жилища, гигиена, дороги, разделение труда, земледелие, суды, регулярная армия, университеты, правительства – можете сами продолжить список), и историю всех этих усовершенствований можно проследить лишь до Древнего Рима, а прежде Рима нет ничего, кроме примитивных общин охотников и собирателей. Ни намека на Древнюю Грецию, Китай, Египет, Левант, Персию и т. д. – лишь многочисленные следы охотников и собирателей. Только представьте: ученые ищут цивилизации, существовавшие до Рима – ведь это помогло бы понять, как появился он сам. Найдены сотни памятников материальной культуры, но всякий раз оказывается, что находки датируются более поздними временем, чем возник Рим. Все эти города, которые выглядели древними, на самом деле построены в “темные века”, а их основатели вели родословную от жителей Древнего Рима. Все дороги ведут в Рим. И Рим, выходит, действительно был построен в один день.
Может, это похоже на бред, но ситуация очень близка к существующей в современной биологии. Никаких “переходных” цивилизаций – связующего звена между бактериями и эукариотами. Те немногие организмы, которые “притворяются” переходными формами (архезои; гл. 1), имеют славное прошлое. С ними случилось то же, что с Византией, когда после блестящих времен империя спряталась в скорлупе городских стен. Как распутать клубок? На самом деле филогенетика содержит ключ, который закономерно ускользал при изучении отдельных генов, но в эру полногеномных сравнений был обнаружен.
Химеризм и начало сложности
Проблема восстановления хода эволюции по одному гену (даже очень консервативному, например по гену рРНК) заключается в том, что один ген, по определению, должен порождать ветвящееся дерево. У одного гена в одном организме не может быть двух историй – он не может быть химерным[68]. В идеальном (с точки зрения филогенетиков) мире все деревья, построенные по отдельному гену, совпадают, отражая общую историю всех генов. Но, как мы убедились, чем дальше мы углубляемся в эволюционное прошлое, тем реже совпадают деревья. Стандартный подход состоит в том, чтобы сосредоточиться на нескольких генах, которые действительно имеют общую историю (их в лучшем случае несколько десятков), и утверждать, что построенное по ним филогенетическое дерево – “единственное достоверное”. Если бы это было так, эукариоты являлись бы близкими родственниками архей. Вот дерево жизни из учебников (рис. 15). Степень родства архей и бактерий – спорный вопрос (разные методы и гены дают разные ответы), однако долго считалось, что эукариоты и археи являются сестринскими группами. Я люблю показывать на лекциях это дерево жизни. Длина ветвей здесь отражает генетическую дистанцию. Ясно, что у бактерий и архей степень генетической вариативности не меньше, чем у эукариот, – так что же случилось на длинной ветви, отделяющей архей от эукариот? Это дерево не дает ни единой подсказки.
Но рассмотрение полных геномов дает совершенно иную картину. Многие эукариотические гены не имеют аналогов у бактерий или архей, хотя доля таких генов по мере увеличения точности методов сокращается. Такие уникальные гены получили название эукариотических “сигнатурных генов”. Но даже стандартные методы показывают, что приблизительно треть эукариотических генов на самом деле имеет эквиваленты у прокариот. Эти гены, по-видимому, унаследованы прокариотами и эукариотами от общего предка (гомологичные гены). И здесь интересно вот что. Далеко не все гены в составе одного эукариотического генома унаследованы от одного предка. Около 3/4 эукариотических генов, у которых есть прокариотические гомологи, имеют, судя по всему, бактериальное происхождение, а 1/4, похоже, досталась от архей. Это относится ко всем эукариотам, в том числе к людям. И дрожжи, и плодовые мушки, и морские ежи, и цикады – все они почти такие же, как мы. Похоже, на уровне геномов все эукариоты химеричны.
Это факт. А вот по поводу его значения ведутся ожесточенные споры. Так, последовательности эукариотических “сигнатурных” генов не похожи на последовательности известных генов прокариот. Почему? Возможно, потому, что эти гены очень древние и их появление может относиться ко времени возникновения жизни, – я бы предложил это назвать гипотезой почтенных эукариот. Эти гены были получены от общего предка настолько давно, что сходство с изначальным состоянием (и с генами бактерий) осталось во мраке времен. Но в этом случае эукариоты должны были обзавестись разнообразными прокариотическими генами гораздо позднее – например, когда они приобрели митохондрии.
Идея эукариотической древности находит отклик в душе тех, кто считает эукариот лучше других. Как ни странно, эмоции и личные предпочтения играют в науке поразительно большую роль. Некоторые исследователи носились с идеей резких катастрофических изменений, другие отдавали предпочтение непрерывным плавным метаморфозам – эволюция “прыжками” против эволюции “ползком”. И то, и другое имеет место. Случай с эукариотами, похоже, апеллирует к бессознательному антропоцентризму. Мы эукариоты, и мысль, будто мы выскочки, возникшие буквально вчера генетические помеси, оскорбляет нас. Некоторым ученым нравится думать, что эукариоты отделились от дерева жизни у самого его основания, и я вижу этому главным образом эмоциональные причины. Ошибочность этого взгляда трудно доказать, но если он справедлив, почему эукариотам потребовалось ждать 2,5 млрд лет, прежде чем стать крупными и сложными? Почему палеонтологическая летопись не хранит никаких следов древних эукариот (в то время как прокариот множество)? И, если эукариоты процветали так долго, почему не осталось эукариот, существовавших до приобретения митохондрий? Мы уже поняли, что нет причин предполагать их низкую конкурентоспособность и последующее вымирание – существование архезоев (гл. 1) наглядно демонстрирует возможность выживания морфологически простых эукариот в течение сотен миллионов лет наряду с более сложными эукариотами и бактериями.
Есть и альтернативное объяснение того факта, что эукариотические сигнатурные гены сильно отличаются от прокариотических: возможно, они эволюционировали быстрее, чем другие гены, и утратили былое сходство последовательностей. Почему же они эволюционировали быстрее? Это могло произойти в том случае, если прокариотическим предкам этих генов пришлось сменить свою функцию под давлением отбора. Мне кажется это очень убедительным. У эукариот хватает генных семейств, в которых многие дуплицированные гены адаптированы для выполнения совершенно разных задач. Эукариоты осваивали мир морфологической сложности, куда вход прокариотам по каким-либо причинам был заказан, поэтому неудивительно, что прокариотические гены приходилось приспосабливать к выполнению абсолютно новых задач, из-за чего они быстро теряли сходство с предшественниками. Скорее всего, эти гены действительно произошли от архейных или бактериальных генов, но адаптация к новым задачам изменила их до неузнаваемости. Ниже я постараюсь доказать, почему это действительно так. А пока отметим, что существование эукариотических “сигнатурных” генов не исключает той возможности, что эукариотические клетки, по сути, химеричны, то есть представляют собой результат слияния прокариот.
А что насчет эукариотических генов, у которых есть идентифицированные прокариотические гомологи? Почему одни из них получены от бактерий, а другие – от архей? Это соответствует идее химерического происхождения. Но сколько было источников? Рассмотрим “бактериальные” гены эукариот. В ходе полногеномного сравнения эукариот и бактерий филогенетик Джеймс Макинерни показал, что бактериальные гены эукариот родственны генам из множества прокариотических групп. На филогенетическом дереве это выглядит как ветви, тянущиеся от разных групп прокариот. Совершенно не похоже, что все бактериальные гены эукариот происходят от одной-единственной группы современных бактерий, например от альфа-протеобактерий, – как можно было бы предположить, считая, что все такие гены должны быть унаследованы от бактерий-предков митохондрий. Совсем наоборот: оказывается, минимум 25 групп современных бактерий подарили свои гены эукариотам. То же самое относится к археям. Хотя, похоже, сделавших вклад групп архей гораздо меньше. Еще любопытнее, что (это показал Билл Мартин) эти бактериальные и архейные гены внутри дерева эукариот ветвятся вместе (рис. 21). Очевидно, эти гены были приобретены эукариотами на довольно раннем этапе эволюции и с тех пор ведут общую историю. Это исключает возможность постоянного горизонтального переноса во время существования эукариот. По-видимому, при их возникновении произошло нечто странное. Похоже, будто первые эукариоты приобрели у прокариот тысячи генов – и больше никогда не вступали с ними в обмен. Проще всего объяснить это не горизонтальным переносом, как у бактерий, а характерным для эукариот эндосимбиозом.
На первый взгляд, случаев эндосимбиоза было много, и теория серийных эндосимбиозов как раз об этом и говорила. Но все же довольно трудно поверить в то, что 25 разных бактерий и 7–8 архей слились в эндосимбиотической оргии – так сказать, приняли участие в происходившем в клетке фестивале свободной любви, и после таких близких отношений – ничего, ни звоночка за всю историю эукариот. Но если ничего такого не было, как можно объяснить это явление? Очень просто: горизонтальным переносом генов. И – нет, я не противоречу себе. При возникновении эукариот один-единственный раз мог произойти эндосимбиоз, а затем между бактериями и эукариотами могло не быть почти никакого обмена генами. Но все это время между группами бактерий активно шел горизонтальный перенос генов. Почему эукариоты имеют гены, общие с 25 группами бактерий? Это может объясняться тем, что эукариоты приобрели большое число генов от единственной популяции бактерий, которая впоследствии изменилась. Возьмем случайный набор генов от 25 групп бактерий и поместим их в геном одной популяции. Предположим, что эти бактерии стали предками митохондрий и жили 1,5 млрд лет назад. Сейчас уже не осталось клеток, которые были бы в большой степени на них похожи, но, учитывая активный горизонтальный перенос у бактерий, это не должно удивлять. Некоторые бактерии из этой популяции вступили в эндосимбиоз. Другие сохранили свой свободный образ жизни и провели следующие полтора миллиарда лет, занимаясь горизонтальным переносом и обмениваясь генами, как и по сей день поступают бактерии. Так горстка генов, принадлежащих изначальной популяции, оказалась рассеянной по множеству современных групп.
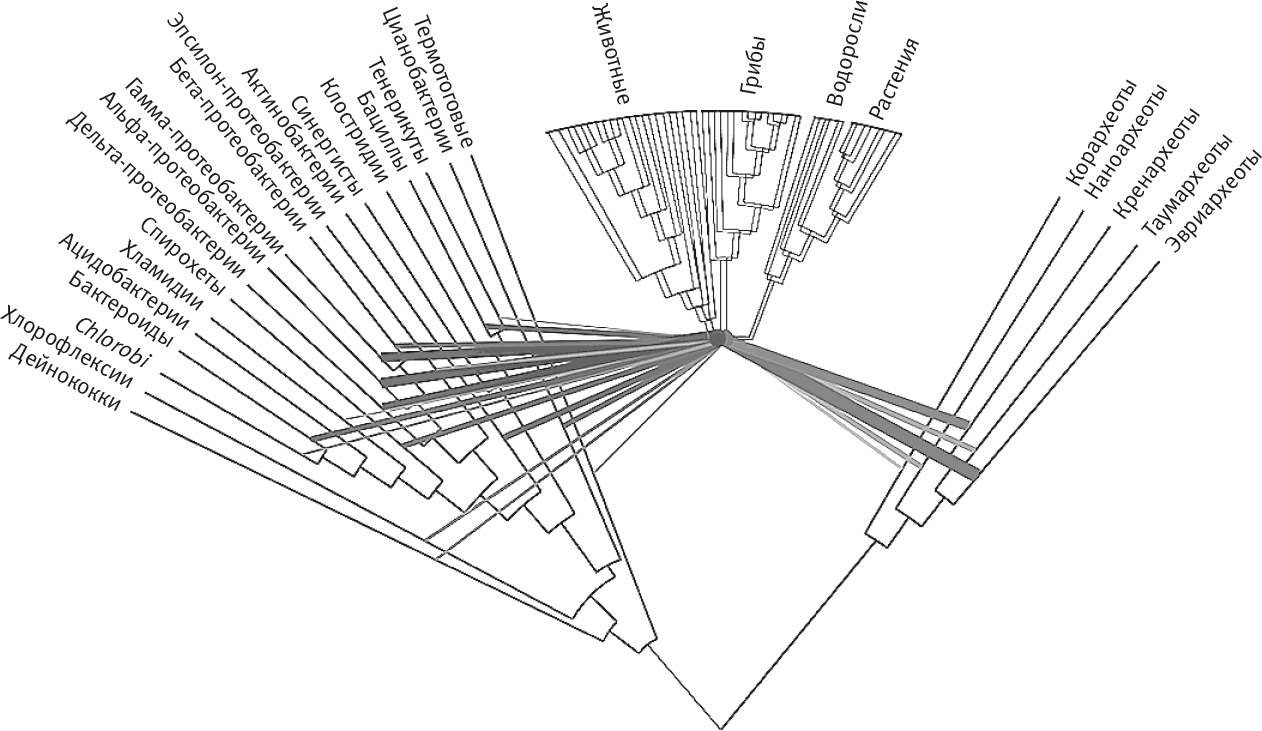
Рис. 21. Поразительный химеризм эукариот.
Многие эукариотические гены имеют эквиваленты у бактерий и архей, но число их явных источников поразительно: вы можете убедиться сами, посмотрев на древо, построенное Биллом Мартином и его коллегами. Здесь представлены наиболее точные соответствия эукариотических генов, прокариотическое происхождение которых не вызывает сомнений, различным группам прокариот и архей. Более толстые линии указывают на то, что из этого источника произошло большее число генов. Например, оказывается, что значительная доля генов унаследована от эвриархеот. Большое количество источников можно рассматривать как результат множественных эндосимбиозов или горизонтального переноса генов, но морфологических свидетельств этому нет. К тому же трудно объяснить, почему эти прокариотические гены у эукариот собрались вместе. Это наводит на мысль, что в ранней эволюции эукариот существовало эволюционное окно, когда приобретение генов шло очень активно – а после этого ничего не происходило 1,5 млрд лет. Наиболее простое объяснение заключается в том, что у археи и бактерии был единственный эндосимбиоз. Ни в одной современной группе нет организма, который имеет геном, совпадающий с геномом одного из них. В результате последующего горизонтального переноса генов между потомками этих клеток и другими прокариотами появились современные группы, обладающие нынешним набором генов.
То же относится и к клетке-хозяину. Возьмите гены 7–8 групп архей и поместите их в предковую популяцию, существовавшую 1,5 млрд лет назад. Некоторые из этих клеток приобрели эндосимбионтов, которые эволюционировали в митохондрии. А оставшиеся продолжили вести себя так, как обычно ведут себя археи, разбрасывая гены направо и налево в ходе горизонтального переноса. Обратите внимание, что этот сценарий являет собой пример “обратной разработки” и опирается только на то, что мы точно знаем: что горизонтальный перенос широко используется бактериями и археями и гораздо менее распространен среди эукариот. Еще этот сценарий предполагает, что некая прокариотическая клетка (архея, которая по определению не способна заглатывать другие клетки путем фагоцитоза) могла приобрести эндосимбионтов при помощи какого-либо иного механизма. (Мы вернемся к этому вопросу позднее.)
Это наиболее простой сценарий происхождения эукариот – единичное событие, результатом которого стало рождение химеры из архейной клетки-хозяина и бактериального эндосимбионта. Я не жду, что вы мне поверите, и лишь хочу сказать, что этот сценарий, наряду с некоторыми другими, согласуется со всеми нашими знаниями о филогении эукариот. Я отдаю предпочтение этому взгляду, поскольку он соответствует принципу бритвы Оккама: предлагает наиболее простое объяснение известных данных. К тому же существуют очень убедительные (и они кажутся все убедительнее) филогенетические свидетельства, предоставленные Мартином Эмбли и его коллегами из Ньюкасла, говорящие в пользу того, что так все и было (рис. 22).
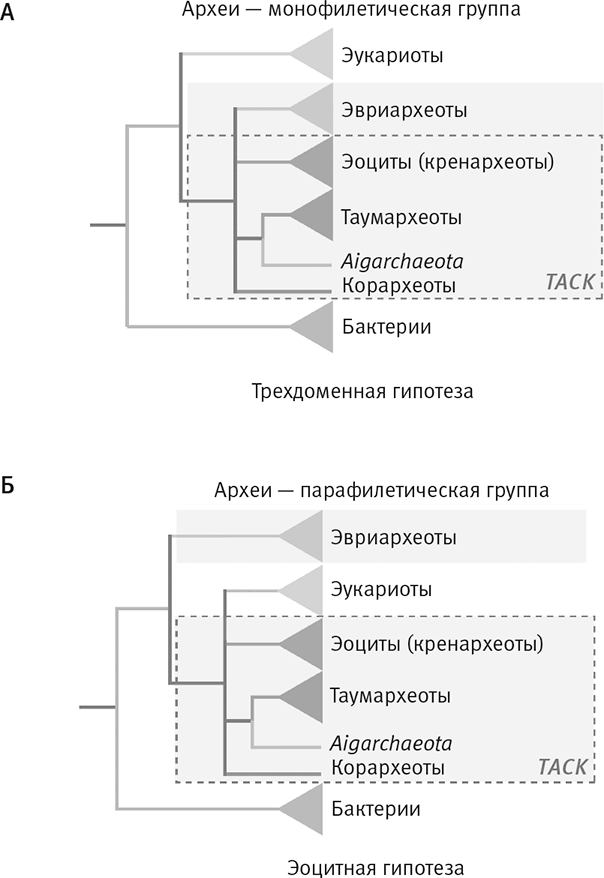
Рис. 22. Два, а не три, первичных домена жизни.
Мартин Эмбли и его коллеги подтвердили, что эукариоты произошли от архей. На рисунке A традиционное трехдоменное дерево, в котором каждый домен монофилетичен (то есть имеет единое происхождение): эукариоты сверху, бактерии снизу, археи разделены на несколько групп (каждая наиболее близко родственна другим археям, а не бактериям или эукариотам).
Новое, гораздо более убедительное альтернативное дерево (Б) построено на основе гораздо более широкой выборки и большого числа участвующих в транскрипции и трансляции информационных генов. Здесь эукариоты на основании сопоставления этих генов предстают группой внутри архей, родственной эоцитам – специфической группе архей. Возможно, клетка-хозяин, которая приобрела бактериального эндосимбионта, была полноценной, похожей на эоцит археей, а значит, не была “примитивным фагоцитом”. Аббревиатурой TACK обозначен суперфилум, в который входят Thaumarchaeota, Aigarcheota, Crenarchaeota и Korarchaeota.
Почему бактерии остаются бактериями
Смысл в том, что прокариоты – и бактерии, и археи – хемиосмотичны. Выше мы обсудили, как в стенах гидротермальных источников могли возникнуть первые клетки, как естественный протонный градиент мог запустить углеродный и энергетический метаболизм и почему из-за использования протонных градиентов могли возникнуть такие глубокие различия между бактериями и археями. Эти соображения могут объяснить, как возникло хемиосмотическое сопряжение, но они не дают ответа на вопрос, почему оно закрепилось у всех бактерий, архей и эукариот. Можно ли потерять хемиосмотическое сопряжение или заменить его чем-нибудь получше?
Некоторым организмам это удалось. Дрожжи и некоторые бактерии большую часть времени заняты брожением. В процессе вырабатывается энергия в форме АТФ. Это быстрый, однако неэффективный процесс. Облигатные бродильщики за короткое время успевают загрязнить собственную среду обитания, что не позволяет им самим расти дальше. Но отходы их жизнедеятельности, например этанол или лактат, служат прекрасным субстратом для роста других организмов. Хемиосмотические клетки могут сжигать свои отходы при помощи кислорода или других веществ, например нитрата. Это позволяет получить гораздо больше энергии и, следовательно, быстрее расти. Брожение хорошо работает в сообществе клеток, когда другие клетки окисляют конечные продукты, но его возможности сами по себе очень ограничены[69]. Есть очень весомые свидетельства в пользу того, что брожение возникло позднее, чем дыхание. Учитывая упомянутые термодинамические ограничения, это весьма логично.
Возможно, это прозвучит неожиданно, но брожение – это единственная известная альтернатива хемиосмотическому сопряжению. Все формы дыхания, все формы фотосинтеза, вообще все формы автотрофии, когда клетки растут лишь на неорганических веществах, – строго хемиосмотичны. Мы указали некоторые причины этого в гл. 2. Так, хемиосмотическое сопряжение удивительно многогранно. Дыхательную цепь можно сравнить с операционной системой компьютера. В “операционную систему” можно устанавливать “новые программы” – механизмы, позволяющие использовать огромное множество доноров и акцепторов электронов. Гены, кодирующие такие механизмы, могут передаваться горизонтальным переносом и без проблем встраиваться в дыхательные цепи других организмов. Таким образом, хемиосмотическое сопряжение делает возможным адаптацию метаболизма почти к любым условиям за небольшое время. Неудивительно, что оно есть у подавляющего большинства организмов!
Но это не все. Хемиосмотическое сопряжение позволяет выжимать энергию из любой среды. Метаногены используют реакцию H2 и CO2 для обеспечения энергетического и углеродного метаболизма. Мы уже упоминали, что заставить H2 и CO2 вступить в реакцию друг с другом непросто – на преодоление энергетического барьера нужно затратить энергию. Метаногены, чтобы вынудить H2 и CO2 реагировать, прибегают к бифуркации электронов. Рассмотрим с позиции общей энергетики историю немецкого дирижабля “Гинденбург”. Наполненный водородом аппарат, преодолев Атлантический океан, взорвался, как зажигательная бомба. С тех пор водород имеет дурную репутацию. H2 и O2 остаются стабильными и не реагируют друг с другом, если их не подтолкнуть – даже искры достаточно, чтобы запустить реакцию, в результате которой выделяется огромное количество энергии. В случае H2 и CO2 проблема обратная: “искра” должна быть относительно большой, тогда как количество выделяемой энергии довольно незначительное.
Клетки сталкиваются с довольно интересным ограничением в том случае, если количество полезной энергии, которое должно выделяться в ходе реакции, превышает количество затраченной энергии менее чем в два раза. Вспомните, как на уроках химии нужно было уравнивать реакции. Одна целая молекула должна реагировать с другой целой молекулой – не может быть, чтобы половина молекулы вступала в реакцию с тремя четвертями другой. Представьте, что в клетке при затрате 1 АТФ на выходе получается меньше, чем 2 АТФ. Не бывает 1,5 АТФ – только один или два. Выходит, нужно затратить 1 АТФ, чтобы после получить 1 АТФ. Чистая прибыль нулевая. Расти лишь на H2 и CO2, используя стандартные химические реакции, не получится. Это относится не только к H2 и CO2, но и к многим другим парам “окислитель – восстановитель” (донор электрона и акцептор), например метану и сульфату. Однако, несмотря на это базовое химическое ограничение, клетки прекрасно растут на таких окислительно-восстановительных парах, потому что энергия протонного градиента при транспорте протонов через мембрану возрастает постепенно, маленькими шагами. Красота хемиосмотического сопряжения в том, что оно выходит за пределы обычной химии. Оно позволяет клеткам накапливать “разменную монету”. Если для образования 1 АТФ требуется 10 протонов, а в результате какой-нибудь химической реакции выделяется энергия, которой хватает на транспорт 4 протонов, нужно просто повторить эту реакцию трижды. В итоге будет выкачано 12 протонов, и 10 из них пойдет на образование 1 АТФ. Хемиосмотическое сопряжение абсолютно необходимо для некоторых форм дыхания и просто полезно: благодаря нему клетки могут сохранять небольшие порции энергии, которые иначе были бы рассеяны в виде тепла: копейка рубль бережет. Эта возможность и возвышает протонные градиенты над обычной химией.
Энергетические выгоды хемиосмотического сопряжения вполне объясняют тот факт, что оно сохраняется уже 4 млрд лет. Но использование протонных градиентов имеет и другие аспекты, успешно учтенные в работе клетки. Чем глубже корни механизма, тем больше вероятность, что он послужит основой для разных, мало связанных друг с другом приспособлений. Например, энергия протонных градиентов широко используется для того, чтобы захватывать из среды питательные вещества и выбрасывать отходы, чтобы вертеть бактериальный жгутик – пропеллер, благодаря которому клетка может передвигаться, чтобы выделять тепло в результате преднамеренного рассеивания протонного градиента (как происходит в клетках бурого жира). Еще любопытнее то, что коллапс протонных градиентов служит сигналом для быстрой запрограммированной гибели клеток в бактериальных популяциях. Клетка, зараженная вирусом, скорее всего обречена. Если она сумеет убить себя быстро – до того, как вирус размножится, – то ее родня (соседние клетки, с которыми она имеет общие гены) получит шанс уцелеть. Поэтому гены, которые отвечают за клеточную смерть, распространятся в популяции. Но гены, несущие смерть, должны срабатывать без промедления. Трудно найти способ более быстрый, чем нарушение целостности клеточной мембраны. Многие клетки поступают именно так: будучи зараженными, они формируют поры в мембране, сводя на нет протон-движущую силу. А это, в свою очередь, пробуждает спящую смертоносную машинерию. Протонные градиенты стали главными сенсорами клеточного благосостояния, арбитрами жизни и смерти. (Эту их функцию мы рассмотрим ниже.)
Итак, мы убедились в том, что универсальность хемиосмотического сопряжения не похожа на результат счастливой случайности. Скорее всего, его появление связано с происхождением жизни и возникновением клеток в щелочных гидротермальных источниках (наиболее вероятных инкубаторах жизни). И то, что им пользуются почти все организмы, о многом говорит. Теперь ясно, что механизм, на первый взгляд странный, на самом деле таковым не является: наш анализ позволяет предположить, что хемиосмотическое сопряжение должно быть свойственно буквально всем формам жизни в космосе. А значит, везде жизни придется преодолевать те же затруднения, с которыми сталкиваются бактерии и археи на Земле: связанные с тем, что прокариоты перекачивают протоны через свои мембраны. Это не ограничивает возможностей развития существующих прокариот (скорее наоборот), однако устанавливает пределы возможного. Невозможное (ниже я расскажу об этом) – это то, чего не бывает, а крупных морфологически сложных прокариот с большими геномами не существует.
Суть в количестве доступной энергии, которая приходится на один ген. Я несколько лет блуждал во тьме, медленно приближаясь к этой идее, но лишь ожесточенные споры с Биллом Мартином помогли довести ее до ума. На нас вдруг снизошло озарение: ключ к эволюции эукариот лежит в простой идее “энергии на ген”! Меня трясло от возбуждения. Неделю я лихорадочно делал подсчеты на клочках бумаги. В итоге, исписав гору бумажек, я пришел к ответу, который поразил нас обоих. Ответ был основан на данных из литературы и представлял собой численную оценку энергетической пропасти, разделяющей прокариот и эукариот. По нашим расчетам, у эукариот на один ген приходится минимум в 200 тыс. раз больше энергии, чем у прокариот. В двести тысяч раз! В конце концов мы выяснили природу пропасти, из-за которой бактерии и археи не достигли уровня сложных эукариот и из-за которой мы вряд ли когда-нибудь встретим инопланетянина, состоящего из бактериальных клеток. Представьте, что вы застряли посреди энергетического ландшафта, где пики соответствуют высокой энергии, а впадины – низкой. Так вот, бактерии помещаются на дне самой глубокой впадины, в энергетической пропасти. Она настолько глубока, что, подняв голову, вы увидите лишь уходящие далеко ввысь стены. Неудивительно, что прокариоты остались там на веки вечные.
Сколько энергии приходится на один ген
Ученые сравнивают подобное с подобным. Если речь об энергии, наиболее уместно соотнести ее с массой: подсчитать, сколько энергии приходится на один грамм. Мы можем сопоставить скорость метаболизма 1 г бактерий (приняв за нее скорость потребления кислорода) с той же величиной для 1 г эукариотических клеток. Не думаю, что вы удивитесь, узнав, что бактерии “дышат” быстрее, чем одноклеточные эукариоты – в среднем втрое быстрее. Здесь большинство ученых предпочитает остановиться, чтобы не рисковать, сравнивая теплое с мягким. Мы рискнули. Сравнивать скорости метаболизма на клетку? Никуда не годится. Оценив выборку примерно из 50 видов бактерий и 20 видов одноклеточных эукариот, мы обнаружили, что клетки эукариот в среднем в 15 тыс. раз больше по объему, чем бактериальные клетки[70]. Если учесть, что скорость дыхания эукариот втрое ниже, усредненная эукариотическая клетка потребляет за секунду примерно в 5 тыс. раз больше кислорода, чем средняя бактерия. Это просто отражает тот факт, что эукариоты гораздо крупнее и с гораздо большим количеством ДНК. Тем не менее на одну эукариотическую клетку приходится в 5 тыс. раз больше энергии, чем на бактериальную. На что она тратит энергию?
Небольшая доля этой дополнительной энергии расходуется на обслуживание самой ДНК – лишь 2 % энергетического бюджета одноклеточного организма идет на репликацию. По данным Фрэнка Гарольда, старейшего деятеля микробиологической биоэнергетики (и моего героя – хотя наши взгляды не всегда совпадают), на синтез белков клетки тратят целых 80 % энергии[71]. Это потому, что клетки состоят в основном из белков; примерно половина сухого веса бактерии приходится на белки. К тому же производить белки дорого: они представляют собой цепочки аминокислот, соединенных пептидной связью. На каждую пептидную связь нужно затратить по меньшей мере 5 АТФ (это впятеро больше, чем требуется для полимеризации нуклеотидов в ДНК). К тому же каждый белок производится в тысячах копий. Они изнашиваются, их все время нужно чинить и обновлять. В первом приближении энергетическая стоимость жизни клетки близка к стоимости производства белков. Каждый белок кодируется одним геном. Если предположить, что все гены кодируют белки (так и есть – за вычетом различий в экспрессии генов), то чем больше генов в геноме, тем дороже обходится белковый синтез. Это подтверждается простым подсчетом рибосом (“фабрики” в клетках по производству белка), так как между числом рибосом и масштабами синтеза белка есть прямое соответствие. У среднестатистической бактерии E. coli примерно 13 тыс. рибосом. Минимум 13 млн рибосом (то есть в 1–10 тыс. раз больше) содержит единственная клетка печени.
В среднем в клетке бактерий около 5 тыс. генов, в клетке эукариот – от 20 до 40 тыс. (у всем известных инфузорий вдвое больше генов, чем у нас). У эукариот на один ген в среднем приходится в 1200 раз больше энергии, чем в среднем у прокариот. Если мы не ошибаемся, оценивая бактериальный геном в 5 тыс. генов, а эукариотический – в 20 тыс. генов, то количество энергии на ген у бактерий примерно в 5 тыс. раз меньше. Иными словами, эукариоты могут поддерживать в 5 тыс. раз более крупный геном, чем бактерии; могут тратить в 5 тыс. раз больше АТФ на экспрессию каждого гена (например, производя больше копий каждого белка) – или же они могут совмещать две стратегии, что и происходит. “Подумаешь! – скажете вы. – Эукариоты в 15 тыс. раз крупнее. Им нужно чем-то заполнять избыток объема, и это главным образом белок”. Эти сравнения имеют смысл лишь в том случае, если в отношении объемов клеток мы также правы. Мысленно увеличим бактерию до средних эукариотических размеров и рассчитаем, сколько энергии в этом случае она будет тратить на каждый ген. Вы можете подумать, что более крупная бактерия будет располагать большим количеством АТФ. Это так, но ей нужно синтезировать много белков, что требует более масштабных затрат АТФ. Общий баланс зависит от того, как именно эти факторы соотносятся. Мы вычислили, что для бактерий плата за то, чтобы быть крупнее, очень высока: размер имеет значение – и, в случае бактерий, “больше” не значит “лучше”. Напротив, у гигантской бактерии на один ген будет приходиться в 200 тыс. раз меньше энергии, чем у эукариотической клетки того же размера. В этом-то все дело.
При увеличении на порядки размера бактерии неизбежно возникает проблема соотношения площади поверхности и объема. Наша эукариотическая клетка обладает усредненным объемом, который в 15 тыс. раз превышает объем средней бактерии. Предположим для простоты, что клетки имеют форму шара. Чтобы бактерия раздулась до эукариотического размера, нужно увеличить ее радиус в 25 раз. При этом площадь ее поверхности возрастет в 625 раз[72]. Это важно, так как синтез АТФ сосредоточен на поверхности клеточной мембраны. В первом приближении масштабы синтеза АТФ возрастут в 625 раз, линейным образом, в соответствии с увеличением площади.
Однако синтез АТФ, конечно, требует участия белков: дыхательных комплексов, которые перекачивают протоны через мембрану, и АТФ-синтаз – молекулярных “турбин”, которые осуществляют синтез АТФ за счет потока протонов. При увеличении площади мембраны в 625 раз масштабы синтеза АТФ могут вырасти лишь в 625 раз, и то при условии, что количество дыхательных цепей и АТФ-синтаз росло пропорционально, а их концентрация на единицу площади осталась такой же[73]. Это, несомненно, так, но ход рассуждений не совсем верен. Все эти дополнительные белки должны быть сначала произведены, а затем встроены в мембрану. Для этого требуются рибосомы и факторы сборки всех нужных видов. Их также нужно синтезировать. Также к рибосомам должны быть доставлены аминокислоты и РНК, но и их нужно прежде произвести, как и необходимые гены и белки. Чтобы поддерживать эту возросшую синтетическую активность, через мембрану увеличенной площади должно переправляться больше питательных веществ, а для этого нужны специальные транспортные белки. И, конечно, нужно синтезировать новую мембрану, для чего необходимы ферменты липидного синтеза. И так далее. Этот грандиозный всплеск активности не может быть обеспечен одним лишь геномом. Только представьте: геном остался крошечным, а на него навалилась необходимость производить в 625 раз больше рибосом, белков, РНК и липидов, как-то перемещать их по значительно возросшей клеточной поверхности – и для чего? Лишь для того, чтобы поддерживать синтез АТФ на исходном уровне: сохранить то же соотношение количества АТФ на единицу площади. Понятно, что это невозможно. Вообразите, что какой-нибудь город вырос в 625 раз, в нем появились новые школы, больницы, магазины, детские площадки, станции для переработки отходов и т. д. Местное правительство, ответственное за все эти приятные нововведения, вряд ли сможет содержать их с помощью прежнего бюджета.
Учитывая скорость роста бактерий и высокую оптимизацию их генома, весьма вероятно, что белковый синтез на каждом геноме и так близок к максимально возможному[74]. Чтобы увеличить масштабы белкового синтеза в 625 раз, логичнее сделать 625 полных копий бактериального генома, каждая из которых будет работать примерно одинаково.
На первый взгляд эта идея кажется бредовой, но это не так. Совсем скоро мы вернемся к этому вопросу, а сейчас рассмотрим энергетическую стоимость такого приобретения. У нас в 625 раз больше АТФ, чем раньше, но и в 625 раз больше геномов, причем за использование каждого нужно платить одинаково. Так как речь не идет о сложной внутренней транспортной системе, которая могла бы сформироваться лишь за многие поколения и при условии крупных энергетических вложений, все эти геномы отвечают за один и тот же “бактериальный” объем цитоплазмы, одну и ту же площадь мембраны и т. д. Наверное, эту раздутую бактерию лучше рассматривать не как единичную клетку, а как совокупность 625 одинаковых клеток. Очевидно, количество “энергии на ген” у каждой из слившихся единиц остается прежним. Поэтому увеличение площади поверхности не приносит бактерии никакой энергетической выгоды. Раздувшаяся бактерия сильно проигрывает эукариотической клетке. У эукариот в 5 тыс. раз больше энергии на ген, чем в среднем у бактерий. Если увеличение площади никак не влияет на количество доступной энергии на ген, оно по-прежнему остается в 5 тыс. раз ниже, чем у эукариот.
Даже хуже! Мы увеличили площадь поверхности в 625 раз, во столько же раз увеличив и затраты энергии, и масштаб ее прибыли. А что с внутренним объемом? Он вырос в 15 тыс. раз! В результате наших экспериментов получился огромный клеточный пузырь, метаболические процессы внутри которого мы оставили без внимания, будто решив, что его содержимое вообще не требует энергии. Это было бы так, если бы весь его объем занимала гигантская, метаболически инертная вакуоль. Но если в бактериальной клетке и вправду будет такая вакуоль, эта бактерия не будет идти ни в какое сравнение с эукариотами, которые не только в 15 тыс. раз крупнее, но и содержат изощренную биохимическую машинерию. Эта машинерия состоит главным образом из белков, и на ее поддержание нужно тратить соответствующее количество энергии. Если принять в расчет все белки, ход рассуждений остается примерно таким же. Немыслимо, чтобы клеточный объем мог возрасти в 15 тыс. раз, если количество геномов не увеличится примерно во столько же. Однако масштабы синтеза АТФ не могут возрастать в той же мере: они зависят от площади мембраны клетки, а ее мы учли. Получается, что увеличение бактерии до размеров среднестатистической эукариотической клетки влечет за собой возрастание масштабов синтеза АТФ в 625 раз, но увеличивает энергетические затраты до 15 тыс. раз. Количество энергии, приходящееся на одну копию каждого гена, должно упасть в 25 раз. Умножьте это на 5 тыс. в соответствии с разницей в энергии на ген (после поправки на размер генома), и мы увидим, что при равном размере геномов и одинаковых объемах клеток гигантская бактерия будет иметь в 125 тыс. раз меньше энергии на ген, чем у средней эукариотической клетки. У средней! А у крупных эукариот, например амеб, по меньшей мере в 200 тыс. раз больше энергии на ген, чем у гигантской раздутой бактерии. Вот откуда взялась наша цифра.
Может показаться, что это игры с числами, которые не несут никакого смысла. Должен признаться, и меня это беспокоило: цифры в буквальном смысле слова невероятны, но, во всяком случае, эти теоретические расчеты позволяют делать предсказания. Например, такое: гигантские бактерии должны иметь тысячи копий собственного полного генома. Что ж, это предсказание просто проверить. Гигантских бактерий мало, но они существуют. Два вида таких бактерий хорошо изучены. Epulopiscium встречается лишь в анаэробной среде задней кишки рыбы-хирурга. Это настоящий линкор среди клеток: обтекаемой формы, около полумиллиметра в длину, видимый даже невооруженным глазом. Он гораздо крупнее большинства эукариот, в том числе инфузории (рис. 23). Почему Epulopiscium стал таким огромным, неизвестно. Thiomargarita еще крупнее: ее круглые клетки составляют около миллиметра в диаметре, и основную часть их объема занимает огромная вакуоль. Единственная клетка может вырастать размером с голову плодовой мушки! Thiomargarita живет в океанских водах, которые время от времени насыщаются нитратами за счет восходящих течений. Клетки улавливают нитраты и хранят их в вакуолях, чтобы потом использовать в качестве акцептора электронов. Это позволяет им дышать много недель, когда поток нитрата иссякает. Но дело не в этом. И у Epulopiscium, и у Thiomargarita экстремально высокая полиплоидность. Их геном представлен тысячами полных копий – до 200 тыс. копий у Epulopiscium и 18 тыс. копий в случае Thiomargarita (несмотря на то, что основную часть ее клетки занимает огромная вакуоль).
Оказывается, рассуждения о 15 тыс. геномах – не пустая болтовня. Не только количество, но и пространственная организация геномов соответствуют теории. У обоих организмов геномы располагаются на периферии клетки, в непосредственной близости от клеточной мембраны (рис. 23). Центр клетки метаболически инертен: у Thiomargarita он занят вакуолью, а у Epulopiscium там развиваются дочерние клетки. Практически полная метаболическая инертность внутренней части говорит о том, что клетки экономят на синтезе белков и не хранят геномы глубоко внутри цитоплазмы. Теоретически это означает, что по количеству энергии на ген они сравнимы с обычными бактериями: все копии генома ассоциированы с мембраной, на которой сосредоточены биоэнергетические процессы и которая может поставлять (в виде АТФ) энергию, нужную для поддержания всех копий генов.
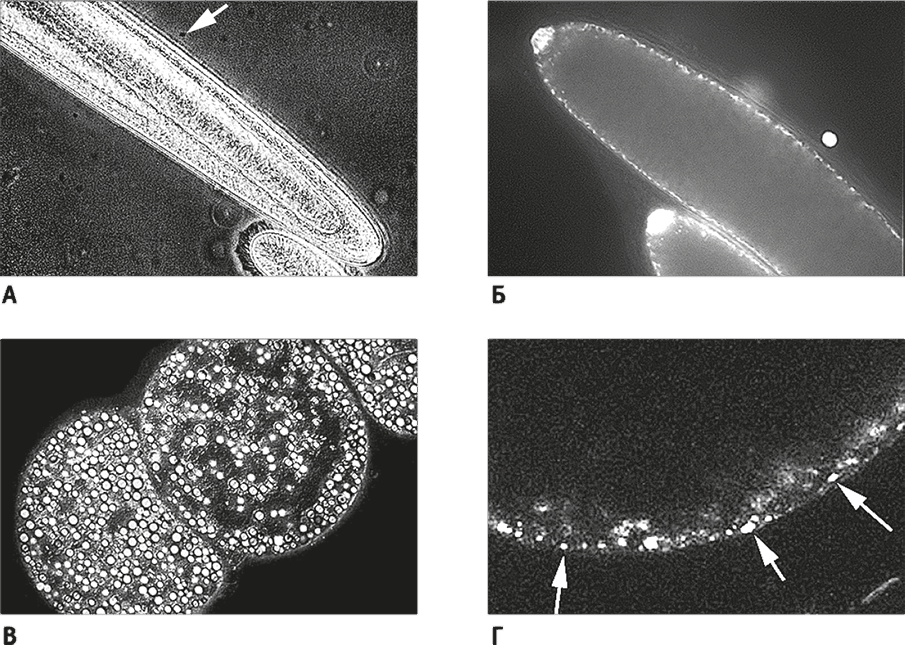
Рис. 23. Гигантские бактерии со “сверхполиплоидией”.
А. Гигантская бактерия Epulopiscium. Стрелка указывает на обычную E. coli, показанную для сравнения. Внизу видна эукариотическая клетка инфузории Paramecium, она кажется маленькой по сравнению с Epulopiscium – этим линкором среди бактерий.
Б. Микропрепарат бактерии Epulopiscium (ДНК окрашена DAPI). Белые точки рядом с мембраной – это полные копии генома. В крупных клетках их число может достигать 200 тыс. Это состояние называется сверхполиплоидией.
В. Еще более крупная бактерия, Thiomargarita, диаметр которой около 0,6 мм.
Г. Thiomargarita (ДНК окрашена DAPI). Большая часть объема клетки занята гигантской вакуолью (черное пространство в верхней части микрофотографии). Вакуоль окружена тонким слоем цитоплазмы, в котором около 20 тыс. полных копий генома (на них указывают белые стрелки).
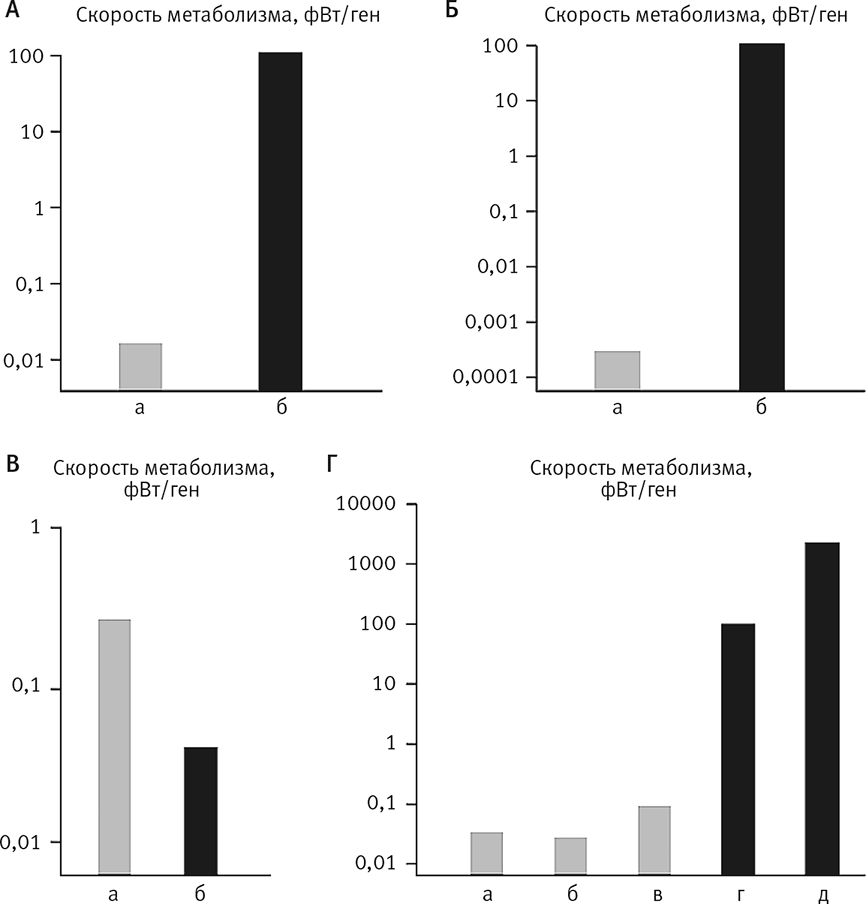
Рис. 24. Сколько энергии у бактерий и эукариот приходится на один ген.
График А показывает усредненные скорости обмена веществ на ген для бактерий (а) и для одноклеточных эукариот (б), выровненные по размеру генома. На графике Б скорости выровнены по клеточному объему. Ось y на всех графиках логарифмична: каждая единица отражает десятикратное изменение величины. Таким образом, одна эукариотическая клетка располагает в 100 тыс. раз большей энергией на ген, чем бактерия, хотя дыхание эукариот (если сравнивать один грамм эукариот с одним граммом прокариот) в три раза медленнее (график В). Эти показатели основаны на измеренных скоростях обмена веществ, но поправки на размер генома и объем клетки теоретические. График Г демонстрирует, что теоретические данные вполне соотносятся с реальностью. Приведены скорости обмена веществ для отдельного генома с учетом его размера, числа копий и объема клетки: а) E. coli, б) Thiomargarita, в) Epulopiscium, г) Euglena, д) Amoeba proteus.
Похоже, так и есть. Скорости метаболизма этих бактерий удалось измерить, и теперь, зная общее число копий генома, мы можем точно рассчитать количество энергии на ген. И – внимание! – эта величина близка (она того же порядка) к таковой у обыкновенной E. coli. Какими бы ни были затраты и прибыли, обусловленные более крупным размером гигантских бактерий, энергетических преимуществ он не предоставляет. Точно в соответствии с предсказанием у этих бактерий на одну копию каждого гена приходится в 5 тыс. раз меньше энергии, чем у эукариот (рис. 24). Заметьте: не в 200 тыс. раз меньше – за счет того, что множественные геномы расположены лишь на периферии клеток, но не внутри. Их внутренний объем почти инертен, из-за чего у гигантских бактерий возникают проблемы с клеточным делением, и это объясняет, почему они не распространены повсеместно.
Бактерии и археи благополучно живут. Маленькие бактерии с небольшими геномами не испытывают недостатка в энергии. Проблемы возникают лишь при попытке увеличить бактерию до эукариотических размеров. При этом у них, в отличие от эукариот, количество энергии на ген падает. Эта энергетическая пропасть громадна. Бактерии не могут увеличить размер генома, а значит, не могут приобрести то огромное число новых генов, которые кодируют признаки, присущие эукариотам. Вместо того чтобы приобрести один гигантский ядерный геном, они останавливаются на накоплении тысяч копий маленьких простых бактериальных геномов.
Как эукариотам удалось выбраться из “энергетической ямы”
Почему аналогичные проблемы с увеличением размеров не возникли у эукариот и не помешали им достигнуть сложности? Все дело в том, что они приобрели митохондрии. Эукариотическая клетка представляет собой генетическую химеру, возникшую, судя по всему, в результате поглощения бактериального эндосимбионта архейной клеткой-хозяином. Как я говорил, этот сценарий согласуется с данными филогенетики, но этих данных недостаточно, чтобы строго его подтвердить. Тем не менее действующие на бактерий жесткие энергетические ограничения близки к тому, чтобы быть доказательствами химерного происхождения сложной жизни. Я покажу, что лишь эндосимбиоз прокариот мог вытащить бактерий и архей из энергетической ямы и что такой эндосимбиоз – одно из редчайших событий в эволюции.
Бактерии – это автономные самовоспроизводящиеся системы, чего нельзя сказать об их геномах. Проблема, с которой сталкиваются гигантские бактерии, состоит в том, что они для поддержания своих размеров вынуждены содержать в клетке несколько тысяч полных копий своего генома. Геном копируется с почти абсолютной точностью, но после копирования не играет почти никакой самостоятельной роли. С геномом работает множество белков, обеспечивающих транскрипцию и трансляцию закодированных в нем генов, клетка делится за счет работы тех же белков, а сам по себе геном инертен, не способен к самостоятельной репликации, как не способен к ней жесткий диск вашего компьютера.
В чем разница между клеткой и ее геномом? Все геномы внутри клетки представляют собой почти идентичные копии, и поскольку они не способны к самовоспроизведению, естественный отбор не влияет на различия между ними. Все различия между геномами внутри одной клетки по мере смены поколений будут сглаживаться до уровня шума. Теперь рассмотрим не геномы, а отдельные бактериальные клетки, конкурирующие друг с другом. Если одна линия клеток приобретет способность делиться вдвое быстрее, чем все остальные клетки, то из-за экспоненциального характера роста такие клетки через несколько поколений будут преобладать в популяции. Конечно, приобретение такого гигантского преимущества в скорости роста маловероятно. Но из-за того, что скорость роста бактерий очень велика, через много поколений даже незначительные ее изменения оказывают заметный эффект на состав популяции. Для бактерий, у которых за день сменяется 70 поколений, начало дня – такое же далекое прошлое, как для людей – начало нашей эры. Скорость роста можно немного увеличить, уменьшая размер генома: например, можно избавиться от гена, необходимость в котором отпала. Не имеет значения, может ли понадобиться этот ген в будущем. Клетки, потерявшие бесполезный ген, делятся быстрее – и через несколько дней начинают вытеснять из популяции клетки, которые его сохранили.
Теперь представим, что условия изменились и прежде бесполезный ген стал жизненно необходим. Потерявшие его клетки уже не смогут расти, если только в ходе горизонтального переноса не приобретут его заново. Бесконечный процесс потери и приобретения генов чрезвычайно широко распространен в бактериальных популяциях. В итоге размер генома стабилизируется до минимально возможного, поскольку у отдельных клеток есть доступ к огромному “метагеному” (общей совокупности генов во всех доступных популяциях). У клетки E. coli около 4 тыс. генов, а ее метагеном содержит около 18 тыс. генов. Конечно, использование метагенома рискованно. Вместо нужного гена можно приобрести мутантный ген или даже генетического паразита, но в итоге стратегия окупается, поскольку плохо приспособленные клетки выходят из игры под давлением естественного отбора, а клетки-победители пожинают лавры.
Теперь представим популяцию бактериальных эндосимбионтов. Она подчиняется тем же базовым закономерностям – ведь это просто популяция бактерий, только небольшая и населяющая ограниченное пространство. Бактерии, потерявшие ненужные гены, размножаются быстрее и будут преобладать в популяции, как и раньше. Главное отличие в стабильности среды, ведь клеточная цитоплазма – среда с очень стабильными условиями, в отличие от постоянно меняющейся внешней среды. Туда трудно попасть, там нелегко выжить, но если это удалось, постоянный поток питательных веществ гарантирован. Вместо характерного для свободноживущих бактерий бесконечного круговорота генетических утрат и приобретений в такой популяции гены утрачиваются окончательно, что ведет к непрерывной оптимизации генома. От генов, потребность в которых исчезла, можно избавиться навсегда, тем самым сократив размеры генома.
Эндосимбиоз редок среди прокариот, которые не способны заглатывать другие клетки путем фагоцитоза. Но некоторые примеры эндосимбиоза у бактерий все же известны (рис. 25), а значит, фагоцитоз для этого не является необходимостью. Некоторые грибы также имеют эндосимбионтов, хотя и не способны к фагоцитозу. Впрочем, у фагоцитирующих эукариот эндосимбиоз встречается гораздо чаще: известны сотни случаев[75]. У всех таких эндосимбионтов наблюдается уменьшение размеров генома. Самые маленькие бактериальные геномы, как правило, принадлежат эндосимбионтам. Так, в геноме возбудителя сыпного тифа Rickettsia, поразившего армию Наполеона, чуть более 1 млн пар нуклеотидов – в 4 раза меньше, чем у E. coli. У Carsonella, эндосимбионта листоблошки, – самый маленький из известных бактериальных геномов: он на 200 тыс. пар нуклеотидов короче, чем геномы хлоропластов некоторых растений. Нам почти ничего не известно о потере генов у эндосимбионтов прокариот, но нет оснований считать, что она происходила иначе. Мы можем быть уверены, что они точно так же теряют гены: митохондрии когда-то были эндосимбионтами, живущими внутри археи.
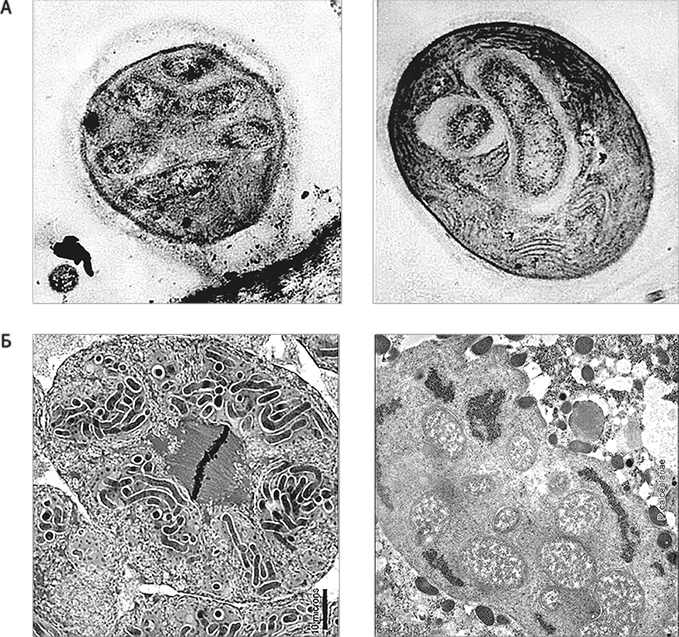
Рис. 25. Бактерии, обитающие внутри других бактерий.
А. Популяция внутриклеточных бактерий, обитающих в организме цианобактерий. Волнистые внутренние мембраны в правой части клетки – это мембраны тилакоидов, место, где у цианобактерий происходит фотосинтез. Клеточная стенка выглядит как окружающий клетку темный контур. Сверху клетка покрыта прозрачной желеобразной оболочкой. Внутриклеточные бактерии видны внутри светлых областей, которые можно принять за фагоцитарные вакуоли, но, по всей вероятности, это результат усыхания препарата. Клетки с клеточной стенкой не способны заглатывать другие клетки (фагоцитоз). Как бактерии попали внутрь – загадка, но они определенно там. Нет сомнений, что бактерии внутри свободноживущих бактерий – явление редкое, но вероятное.
Б. Популяции гамма-протеобактерий внутри клеток-хозяев – бета-протеобактерий, которые сами живут в клетках мучнистого червеца. На микрофотографии слева внизу видна клетка (ядро которой вот-вот разделится в ходе митоза). Внутри у нее шесть эндосимбионтов, каждый содержащий множество палочковидных бактерий. Справа внизу эти бактерии в увеличенном виде. Этот случай не столь удивителен, как пример цианобактерий, потому что симбиоз с эукариотическими клетками – не то же, что свободноживущее состояние.
Потеря генов имеет большое значение. Эндосимбионтам она выгодна, поскольку ускоряет их рост. Кроме этого, она позволяет тратить меньше АТФ. Поставим мысленный эксперимент. Вообразим клетку, в которой живет 100 эндосимбионтов. Каждый эндосимбионт начинает свою жизнь как обычная бактерия, которая со временем теряет гены. Предположим, что изначально такая бактерия имеет бактериальный геном, содержащий 4 тыс. генов, и в течение жизни она теряет 200 генов (5 % генома). Скорее всего, в первую очередь будут утрачены гены синтеза клеточной стенки, которые не нужны для жизни внутри другой клетки. Каждый из 200 генов кодирует белок, на синтез которого нужно затратить энергию. Сколько энергии будет сэкономлено, если эти белки не будут синтезироваться? В среднем каждый бактериальный белок состоит из 250 аминокислотных остатков и присутствует в клетке в 2 тыс. копий. Для создания каждой пептидной связи (химическая связь, соединяющая аминокислотные остатки в белке) нужно потратить около 5 молекул АТФ. Так что 100 эндосимбионтов на синтез 2 тыс. копий 200 белков потратят 50 млрд молекул АТФ. Если мы распределим эту энергию по жизненному циклу клетки, считая, что клетка делится каждые 24 часа, получится, что на синтез этих белков тратится 580 тыс. молекул АТФ в секунду. И это количество АТФ можно сэкономить, если эти белки не синтезируются.
Конечно, у клетки нет необходимости тратить сэкономленный АТФ на что-либо конкретное (хотя некоторые цели есть), но рассмотрим, на что в принципе можно потратить АТФ. Относительно простой признак, отличающий эукариот от остальных организмов – динамический внутренний цитоскелет, способный перестраиваться и изменять свою форму, что обеспечивает движение клеток и внутриклеточный транспорт. Главный компонент эукариотического цитоскелета – белок актин. Сколько актина можно синтезировать при потоке АТФ 580 тыс. молекул в секунду? Актин – это филамент, состоящий из мономеров, соединенных в цепь. Две такие цепи, скрученные в спираль, образуют филамент. Каждый мономер состоит из 374 аминокислот. В одном микрометре актинового филамента содержится 2 ? 29 мономеров. Чтобы построить 1 микрометр актинового филамента, нужно 131 тыс. молекул АТФ (что теоретически позволяет построить за секунду около 4,5 микрометра актина). Если вам показалось, что этого маловато, я напомню, что обычная длина бактериальных клеток – пара микрометров[76]. Поэтому энергии, сэкономленной эндосимбионтами при потере генов (5 % генов), достаточно для развития динамического цитоскелета, что, несомненно, и произошло. Имейте в виду, что 100 эндосимбионтов на клетку – это довольно скромная оценка. У некоторых крупных амеб в клетке минимум 300 тыс. митохондрий.
Но эндосимбионты пошли дальше и утратили не 5 % генов, а гораздо больше. Митохондрии потеряли почти все свои гены: у нас и прочих животных в митохондриях сохранилось лишь 13 белок-кодирующих генов. Если считать, что предки митохондрий не слишком отличались от современных ?-протеобактерий, то их геном должен был кодировать около 4 тыс. генов. Вступив в эндосимбиоз и превратившись в митохондрии, они потеряли более 99 % своего генома. Если мы снова рассчитаем энергетический выигрыш, то получим: если 100 эндосимбионтов потеряют 99 % генов, это позволит сэкономить около 1 триллиона молекул АТФ за 24-часовой жизненный цикл – или 12 млн молекул АТФ в секунду! Но митохондрии не экономят энергию – они производят АТФ. По способности к производству АТФ митохондрии не уступают своим предкам, но в то же время они снизили собственную энергетическую стоимость настолько, насколько было возможно. В результате эукариоты приобрели такую энергию, как у множества бактерий сразу – и при этом сэкономили на синтезе белка. Вернее, они стали получать энергию за чужой счет.
Хотя митохондрии потеряли большую часть своих генов, некоторые из них были перенесены в ядро (подробнее об этом – в следующей главе). Кое-какие из них продолжают кодировать те же белки, что и раньше, и выполняют свои старые функции. Такие гены не способствуют экономии энергии. Но некоторые из перенесенных в ядро генов не были нужны ни эндосимбионту, ни клетке-хозяину. Эти проникшие в ядро “генетические флибустьеры” способны свободно менять свои функции, поскольку действие отбора их не сдерживает. Такие избыточные фрагменты ДНК послужили исходным генетическим материалом в эволюции эукариот. Некоторые из них дали начало целым семействам генов, которые могут выполнять самые разные функции. Известно, что у первых эукариот было около 3 тыс. генных семейств, которых не было у бактерий. Утрата генов митохондриями сделала возможным накопление новых генов в ядре, а их хранение там не потребовало энергетических затрат. Теоретически, если в клетке живет 100 эндосимбионтов и из каждого в ядро будет перенесено 200 генов (около 5 % всех генов эндосимбионта), то клетка-хозяин может приобрести 20 тыс. новых генов (фактически целый человеческий геном!), которые могут применяться во всевозможных целях, и без какой-либо затраты энергии. От новых горизонтов, которые открывает приобретение митохондрий, просто дух захватывает.
Остаются лишь два вопроса, которые тесно связаны друг с другом. Во-первых, все приведенные рассуждения вращаются вокруг проблемы соотношения площади поверхности и объема у прокариот, но некоторые бактерии, например цианобактерии, вполне способны значительно увеличивать площадь поверхности своих биоэнергетических мембран путем их впячивания внутрь клетки и сворачивания в сложные структуры. Почему остальным бактериям не удалось обойти ограничения хемиосмотического сопряжения при помощи впячивания мембран? Во-вторых, если потеря генов имеет такое значение, то почему митохондрии не довели дело до победного конца и не утратили весь геном, что принесло бы им несомненную энергетическую выгоду? Ответив на эти вопросы, мы поймем, почему развитие бактерий за 4 млрд лет не сдвинулось с мертвой точки.
Ключ к сложности – митохондрии
Почему некоторое количество генов у митохондрий все-таки остается? Ответ не так уж очевиден. Сотни генов, кодирующих митохондриальные белки, переместились в ядро еще на ранних стадиях эукариотической эволюции. Теперь продукты этих генов перед тем, как попасть в митохондрии, образуются снаружи, в цитозоле. Но небольшая группа генов, которые кодируют дыхательные белки, несмотря ни на что остается в геноме митохондрий. Почему? Вот что говорит нам классический учебник “Молекулярная биология клетки”: “Мы не можем сказать точно, по какой причине белки, которые образуются в митохондриях и хлоропластах, должны производиться именно там, а не в цитозоле”. Это утверждение в неизменном виде пережило несколько изданий (1983, 1992, 2002, 2008 годов). Но задумывались ли авторы над этой фразой?
То, что известно о происхождении эукариот, позволяет предложить разные ответы на этот вопрос. Их можно отнести к двум категориям: “тривиальные” и “необходимые”. Я использую слово “тривиальный” в нетривиальном смысле: “тривиальный” ответ не подразумевает каких-либо биофизических причин, которые могли заставить митохондриальные гены оставаться в митохондриях. Они остались там не потому, что не могли переместиться, а просто потому, что так сложилось. “Тривиальные” ответы объясняют, почему гены остались в митохондриях, следующим образом: хоть они и могли переместиться в ядро, но в силу сочетания вероятности и сил отбора некоторые из них остались на своем месте. В числе возможных причин можно назвать размер и гидрофобность митохондриальных белков, а также небольшие отклонения в генетическом коде. По сути, “тривиальная” гипотеза гласит, что все оставшиеся митохондриальные гены могут быть перемещены в ядро: произведя соответствующие модификации при помощи методов генной инженерии, мы обнаружим, что клетка продолжает прекрасно работать. Некоторые исследователи активно работают над перемещением митохондриальных генов в ядро, предполагая, что это может предотвратить старение (гл. 7). Эта задача сопряжена с множеством трудностей и совсем не тривиальна в обычном значении этого слова, но она “тривиальна” в том смысле, что основана на вере исследователей в отсутствие необходимости сохранения генов в митохондриях. Они считают, что перемещение этих генов в ядро может принести реальную пользу. Что ж, удачи.
Я не разделяю эту точку зрения. Другая гипотеза – гипотеза необходимости – предполагает, что митохондрии сохранили свои гены потому, что нуждались в них: без них митохондрии просто не смогли бы существовать. Иными словами, причина, по которой гены остались в митохондриях, была абсолютно непреодолимой: переместить гены в ядро было принципиально невозможно. Почему невозможно? Я считаю, что наиболее убедительный ответ предложил биохимик Джон Аллен, с которым я долго сотрудничаю. Я доверяю его мнению не потому, что он мой друг – скорее наоборот: мы стали друзьями отчасти из-за того, что я поверил в его идею. Аллен, обладая деятельным умом, выдвинул множество оригинальных гипотез и десятки лет проверял их. О некоторых мы спорили годами. В пользу этой его гипотезы говорит множество аргументов, а заключается она в том, что митохондрии (как и хлоропласты) сохранили свои гены из-за необходимости контролировать хемиосмотическое сопряжение. Перенесите оставшиеся митохондриальные гены в ядро, – рассуждает Аллен, – и спустя некоторое время клетка умрет, как бы аккуратно ни были гены переставлены на новое место. Митохондриальные гены должны быть именно там, где они есть – рядом с биоэнергетическими мембранами, которые обслуживаются этими генами. Существует термин “бронзовый контроль”[77]. Во время войны “золотой контроль” возлагается на центральные органы власти, которые вырабатывают долгосрочную стратегию, “серебряный контроль” лежит на командовании вооруженными силами, которое занимается распределением солдат и вооружений, а на поле боя все зависит от “бронзового контроля” – мужчин и женщин, которые собственными руками побеждают врага, принимают решения, воодушевляют подчиненных и остаются в истории как великие воины. Так вот, митохондриальные гены – это “бронзовый контроль”, которому то и дело приходится принимать важные решения.
Почему такие решения необходимы? В гл. 2 мы обсуждали протон-движущую силу. Электрический потенциал внутренней мембраны митохондрии составляет примерно 150–200 милливольт. Поскольку толщина мембраны – всего 5 нанометров, это порождает напряженность электрического поля в 30 миллионов вольт на метр – как у вспышки молнии. Горе тому, кто потеряет контроль над таким электрическим зарядом! Расплатой будет не только остановка синтеза АТФ (хотя это само по себе очень серьезно). Если нарушится перемещение электрона по дыхательной цепи к кислороду (или к другим акцепторам электронов), это может привести к “короткому замыканию”, когда электроны реагируют с кислородом или азотом непосредственно с образованием высокоактивных свободных радикалов. Сочетание падения уровня АТФ, деполяризации биоэнергетических мембран и высвобождения свободных радикалов – классический триггер “запрограммированной клеточной смерти”. Выше я упоминал, что это явление широко распространено даже среди одноклеточных бактерий. По сути, митохондриальные гены реагируют на локальные изменения условий, в небольших пределах смещая мембранный потенциал, не позволяя его изменениям стать катастрофическими. Если переставить такие гены в ядро, то, скорее всего, в течение нескольких минут митохондрии просто потеряют контроль над мембранным потенциалом из-за изменений в количествах субстрата или кислорода либо из-за утечки свободных радикалов, и это приведет к гибели клетки.
Чтобы жить, мы должны непрерывно дышать. Нужно обеспечивать точную регулировку мышц диафрагмы, грудной клетки, горла. Она осуществляется и на более низком уровне: похожим образом регулируют дыхание и митохондриальные гены, заботясь, чтобы результат всегда соответствовал потребностям. Только эта причина достаточно важна, чтобы ею можно было объяснить сохранение генов в митохондриях.
Это более чем “необходимая” причина, в силу которой гены остались в митохондриях: нужно, чтобы эти гены были рядом с биоэнергетическими мембранами, где бы те ни находились. Поразительно, но у митохондрий неизменно сохраняются гены, принадлежащие к одному и тому же маленькому подсемейству, характерному для всех способных к дыханию эукариот. В тех редких случаях, когда клетки теряют сразу все митохондриальные гены, они теряют способность дышать. Гидрогеносомы и митосомы (специализированные органеллы, которые произошли от митохондрий и встречаются у архезоев) утратили абсолютно все гены – и в результате потеряли возможность пользоваться энергией хемиосмотического сопряжения. А у гигантских бактерий собственные гены (точнее, полные геномы) расположены совсем рядом с биоэнергетическими мембранами. На мой взгляд, наиболее показательный пример – это цианобактерии с их складчатыми внутренними мембранами. Если гены необходимы для контроля над дыханием, то цианобактерии должны иметь множество полных копий своего генома, как и гигантские бактерии – пусть цианобактерии и мельче. Так и есть: у наиболее сложных цианобактерий до нескольких сотен копий генома. Как и в случае гигантских бактерий, количество доступной энергии на ген у них ограничено: они не могут иметь геном, который хоть сколько-нибудь приближается по длине к ядерному эукариотическому, и вынуждены накапливать маленькие бактериальные геномы.
Вот причина, по которой бактерии не могут достичь размеров эукариот. Если просто переместить биоэнергетические мембраны внутрь и увеличить площадь их поверхности, это не сработает: нужные гены должны оказаться рядом с мембранами. В реальности же, не прибегая к эндосимбиозу, гены можно поместить туда лишь в составе полного генома. С позиции “энергии на ген” нет никакой пользы в том, чтобы увеличиваться в размерах: имеет смысл расти лишь для того, чтобы стал возможен эндосимбиоз. Лишь тогда можно будет терять гены, а сокращение генома митохондрий в несколько раз сделает возможным разрастание ядерного генома на порядки, вплоть до эукариотических размеров.
Можно рассмотреть и другую возможность: использовать бактериальные плазмиды – полуавтономные кольцевые ДНК, в некоторых случаях несущие огромное количество генов. Почему бы не разместить дыхательные гены на одной крупной плазмиде, а после расположить множественные копии этой плазмиды рядом с мембранами? С этим сопряжены трудноразрешимые логические проблемы, но может ли это в принципе работать? Я думаю, что нет. Сам по себе крупный размер не дает прокариотам преимуществ, и иметь избыточное количество АТФ бессмысленно. Маленькие бактерии не страдают от недостатка АТФ. Чуть больший размер и чуть больше АТФ не даст преимущества в конкурентной борьбе – лучше быть немного мельче, иметь достаточное количество АТФ и быстрее делиться. Второй недостаток самого по себе увеличения в размерах – это необходимость организовать пути доставки к удаленным регионам клетки. Большой клетке необходимо транспортировать грузы во все ее части, и эукариотам приходится делать именно это. Но такие транспортные системы появились не за один день: для этого потребовалось множество поколений, а в течение такого долгого времени крупный размер должен был давать какие-нибудь дополнительные преимущества. Поэтому плазмиды не подходят: идея выворачивается наизнанку. Гораздо более простое решение проблемы снабжения – создать множество копий полного генома, чтобы каждая контролировала небольшую часть объема цитоплазмы, равную объему одной бактериальной клетки – так, как у гигантских бактерий.
Как эукариотам удалось преодолеть ограничения в размерах и построить сложные транспортные системы? Что отличает клетку с многочисленными митохондриями, каждая из которых имеет геном размером с бактериальную плазмиду, от гигантской бактерии с множеством плазмид, разбросанных по клетке для контроля над дыханием? Ответ заключается в том, что происхождение эукариот не имело отношения к АТФ: эту идею высказали Билл Мартин и Миклош Мюллер в рамках гипотезы о первой эукариотической клетке. Мартин и Мюллер предположили, что у клетки-хозяина и ее эндосимбионтов существовала экологическая синтрофия: они обменивались субстратами для роста, а не только энергией. Водородная гипотеза гласит, что первые эндосимбионты снабжали своих клеток-хозяев необходимым для роста водородом. Не будем останавливаться на деталях: важно, что без субстрата клетки вообще не могут расти. Эндосимбионты обеспечивают клетку всем нужным субстратом. Чем больше эндосимбионтов, тем больше субстрата и тем быстрее растет клетка-хозяин, – а значит, и ее эндосимбионты. Таким образом, в случае эндосимбиоза более крупные клетки получают преимущество, так как могут вместить больше эндосимбионтов и добыть больше топлива для роста. Еще большую выгоду они получат в том случае, если организуют транспортные пути к собственным эндосимбионтам. Но это почти буквально то же, что ставить телегу (внутриклеточный транспорт) впереди лошади (источник энергии).
По мере того, как эндосимбионты теряют свои гены, уменьшаются их собственные потребности в АТФ. Это приводит к забавному казусу. Клетка в процессе дыхания синтезирует АТФ из АДФ. В свою очередь, АТФ расщепляется обратно до АДФ, а выделяющаяся энергия расходуется на нужды клетки. Если уровень потребления АТФ сильно падает, весь АДФ в клетке превращается в АТФ, что ведет к остановке клеточного дыхания[78]. В таких условиях дыхательная цепь накапливает избыточное количество электронов, становится “перевосстановленной” (гл. 7), и электроны начинают стекать с нее на кислород, что приводит к образованию свободных радикалов, которые повреждают белки, ДНК, даже запускают апоптоз. Возникновение одного из ключевых митохондриальных белков – АДФ/АТФ-транслокатора – позволило клетке-хозяину отвести часть АТФ из клеток эндосимбионтов на свои нужды. Но самое замечательное, что это еще и решило проблему перевосстановления дыхательных цепей эндосимбионтов. За счет отведения избытка АТФ и снабжения эндосимбионтов АДФ клетка-хозяин сократила образование свободных радикалов внутри эндосимбионтов и так снизила риск того, что она сама окажется поврежденной или даже погибнет. Это объясняет, почему и клетка-хозяин, и эндосимбионты заинтересованы в том, чтобы спускать большие количества АТФ на такие расточительные приобретения, как динамический цитоскелет[79]. Но суть в том, что каждая стадия эндосимбиотических взаимодействий оказывается выгодной, в отличие от плазмид, которые не делают выгодным ни увеличение размеров клетки, ни производство большего количества АТФ.
Возникновение эукариот – уникальное событие. За 4 млрд лет это случилось лишь однажды. Если рассматривать причудливую траекторию эволюции в отношении информации и геномов, понять ее закономерности почти невозможно. Но картина приобретает смысл, если взглянуть на нее с позиции энергии и физической структуры клеток. Мы разбирались, как хемиосмотическое сопряжение могло возникнуть в щелочных гидротермальных источниках и почему оно навсегда осталось универсальным и у бактерий, и у архей. Мы убедились, что хемиосмотическое сопряжение обусловило удивительные адаптивные возможности прокариот и их огромное разнообразие. Вероятно, те же факторы играют роль и в возникновении жизни на других планетах: для этого нужно немногим больше, чем горная порода, вода и CO2. А сейчас вы увидите, почему естественный отбор, действующий на бесконечную популяцию бактерий в течение бесконечно долгого времени, не приведет к возникновению крупных и сложных клеток эукариотического типа иначе, чем путем эндосимбиоза.
Нет универсальных или предопределенных путей развития, ведущих к возникновению сложно устроенной жизни. Вселенная не “беременна” идеей нашего существования. Сложная жизнь может возникнуть где угодно, но это очень редкое событие – по этой причине мы не наблюдаем ее повторного возникновения на Земле. Первая часть объяснения проста: эндосимбиоз прокариот довольно редок. Вторая часть менее очевидна и заставляет вспомнить Сартра: “Ад – это другие”. Тесное эндосимбиотическое взаимодействие могло вывести бактерий из затянувшегося эволюционного тупика, но, как мы увидим, из мучительного процесса рождения эукариотической клетки можно понять, почему подобные события чрезвычайно редки и почему сложным формам жизни свойственно много специфических черт, например половое размножение и смерть.
| <<< Назад Часть III О сложности |
Вперед >>> Глава 6 Половое размножение и происхождение смерти |
- Как изменить свое будущее Появление эпигенетики
- История леса. Взгляд из Германии
- Белый мор
- Геологические периоды и развитие растительного и животного мира
- Почему закончилась рыцарская эпоха?
- Открытие Америки
- 12. Общая характеристика формы и периоды инфекции
- Пара слов о влиянии климата
- 1. Плазмодии малярии
- Жизнь на поверхности
- Понятие стресса
- Вражда и дружба на паутине
![Вопрос жизни [Энергия, эволюция и происхождение сложности]](https://ours-nature.ru/new_site/img/1377312123/cover.jpg)