Книга: Геном человека: Энциклопедия, написанная четырьмя буквами
Навигация: Начало Оглавление Другие книги
Индивидуальная пилюля (фармакогеномика)
Некоторые лекарства опаснее самих болезней.
Сенека
Доктора — это те, кто прописывают лекарства, о которых мало знают, чтобы лечить болезни, о которых они знают еще меньше, у людей, о которых они не знают вообще ничего.
Вольтер
Когда на торжественном банкете встречаются друг с другом азиаты и европейцы, то легко заметить, что даже после первого бокала легкого вина у азиатов лица краснеют, тогда как у европейцев они практически не изменяются, может быть, только чуть-чуть розовеют. В чем же причина этого? Здесь в основе различий в реакции на алкоголь также лежит геном человека, вариабельность его и кодируемых им белков. Даже незначительные различия в геномах разных людей порой ведут к существенному изменению реакции организма на разнообразные внешние воздействия, в частности на чувствительность к алкоголю, различным компонентам пищи, а также к всевозможным лекарственным средствам.
Но все это стало понятно сравнительно недавно, хотя научная фармакология существует уже около ста лет. Считается, что началась она с синтеза теперь уже всем хорошо известного лекарственного препарата аспирина. Однако за весь прошедший век фармакологи дали практикующим врачам всего лишь около полутысячи веществ, используемых для изготовления лекарств. При этом впоследствии оказалось, что далеко не все из них обладают только лишь полезными для человека свойствами. Нередко выяснялось, что многие из лекарств могут иметь побочные эффекты, в том числе и обладать весьма токсическим действием. Понадобилось почти 80 лет, чтобы разобраться хотя бы с тем же аспирином. Оказалось, что он подавляет активность одной из разновидностей фермента циклооксигеназы, но одновременно стимулирует другую его разновидность. А вот последнее вместо лечебного эффекта приводит к кровотечениям в клетках слизистой желудка и, как следствие, к развитию гастрита. Дело зачастую в том, что большинство из существующих лекарств представляет собой чуждые для человека вещества, с которыми он практически не сталкивался ранее в природе.
Но все это только одна из проблем. Другая, не менее важная, заключается в том, что даже самые «испытанные» лекарства эффективны далеко не для всех больных. Практика показывает, что зачастую ожидаемый лечебный эффект проявляется менее чем у четверти из них. Вот почему, например, так много разных лекарств имеется в аптеках от кашля, от головной и сердечной боли. Одним помогает одно, другим — другое.
Отчасти все это связано с тем, что вплоть до настоящего времени лекарственные препараты разрабатывались и назначались к применению, пройдя чисто «популяционный» контроль, без учета возможных индивидуальных особенностей реакции организма. А между тем уже довольно давно известно, что от 10 до 40 % людей не реагируют на ту или иную фармакотерапию. В чем же тут дело? Уже много лет назад было установлено, что индивидуальная вариабельность реакции организма на действие лекарственных средств может быть обусловлена генетическими факторами. Тогда же и было сформулировано понятие о фармакогенетике как о науке, изучающей влияние генетических факторов на особенности реакции организма в ответ на медикаментозное воздействие.
Успехи в области изучения генома человека создали научную базу и необходимые технологические предпосылки для дальнейшего прогресса фармакологии. И вот в результате секвенирования генома человека и совершенствования методов генетического анализа, которое произошло в ходе выполнения проекта «Геном человека», окончательно сформировалось целое новое направление — фармакогеномика. Сам термин возник в 1997 году еще в ходе полного секвенирования генома человека. Эта новая быстро развивающаяся наука представляет собой «сплав» фармакогенетики и современных геномных технологий.
Фармакогеномика сфокусировала свое внимание на поиске новых средств лечения с учетом знания о структуре генома человека и на базе изучения генетических основ вариабельности ответа пациентов на лекарства, определяемой различиями в наследственной природе разных людей. Фармакогеномика изучает, как те или иные особенности строения нашей ДНК могут ослабить или усилить воздействие лекарств, разрабатывает тесты на выбор наиболее оптимального сочетания медицинских препаратов для лечения каждого конкретного человека. Таким образом, фармакогеномику можно рассматривать как одно из первых реальных практических приложений результатов, достигнутых участниками международного проекта «Геном человека».
Сейчас поиск новых лекарств в значительной мере отличается от того, что было вчера, а завтра, благодаря фармакогеномике, он должен стать еще более эффективным и точным (рис. 36).
Началось все с «трудов» средневековых алхимиков, когда они пытались найти и создать элексир вечной молодости. Поиск шел в природе, в ее естественных продуктах. Один из подходов, применяемых в недалеком прошлом и не потерявших свою актуальность даже сейчас, — использование в качестве лекарственных средств тех естественных продуктов человеческих клеток, которые способны сами защищать организм от всевозможных патологий. Таких «защитников» довольно много в нашем организме, но не всегда их хватает для борьбы с патологическими процессам. Можно использовать не сами белки-защитники, а некие их усовершенствованные формы. Примером этому может служить путь, по которому шли российские ученые во главе с членом-корреспондентом РАН Н. Ф. Мясоедовым при создании уникального медицинского препарата «Семакс». По своим свойствам — это нейропептид. Обычно нейропептиды вырабатываются клетками нервной ткани и представляют собой, как правило, короткие аминокислотные последовательности, которые обладают высокой эффективностью и выраженной направленностью действия даже при условии их очень малой концентрации. «Семакс» был создан в результате анализа действия различных производных адренокортикотропного гормона на такие фундаментальные функции мозга, как обучение и память. Выяснилось, что пептид, состоящий всего из четырех аминокислот, входящих в состав этого естественного гормона человека, вмешиваясь в нарушенное управление больной клетки, способен восстанавливать ее нормальное состояние. Далее на один из концов этого пептида были искусственно добавлены три специфические аминокислоты, которые защищают его от быстрого разрушения в организме. И в результате появился медицинский препарат нового поколения, который сейчас все шире и шире используется в медицинской практике при лечении травм головного мозга, инсульта и расстройств памяти.
Еще недавно большим достижением считалось «плясать» от конкретного гена. И действительно, это стало весьма важным этапом на пути создания эффективных лекарственных средств.
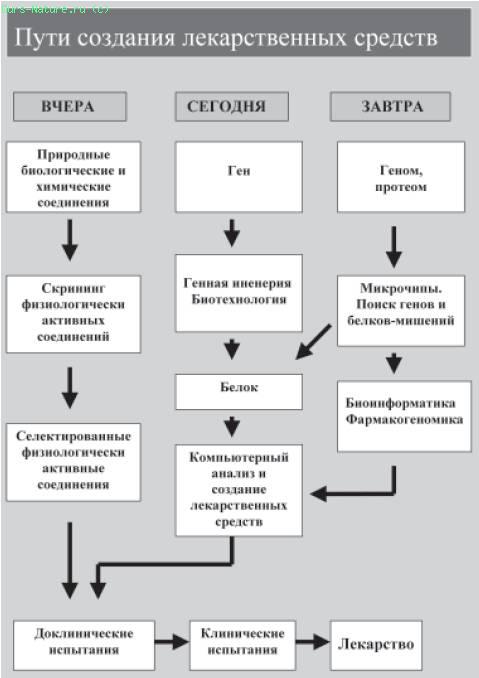
Рис. 36 . Схема, иллюстрирующая в общем виде эволюцию основных путей создания лекарственных средств
Но теперь основные эффективные пути поиска новых лекарственных средств уже базируются на знаниях о полной структуре генома человека, с переходом на знания о структуре всех белков человека (его протеома). Секвенированный геном человека стал «путеводной книгой» для фармацевтических компаний. Появилась, как иногда говорят, «единственная в жизни» возможность идентифицировать все человеческие гены-мишени. Это одна из основных причин, почему вокруг нее ведутся жаркие баталии между двумя основными исполнителями проекта «Геном человека». За все времена до секвенирования генома человека было определено лишь около 500 молекулярных мишений, на которые направлено действие лекарственных веществ. Теперь, благодаря успехам в геномике человека, ожидается десятикратное увеличение таких мишений (по разным оценкам, общее их число у человека может составлять от 5000 до 10000).
Фармакогеномика осуществляет поиск новых мишений на базе двух китов — секвенированной нуклеотидной последовательности ДНК человека и компьютера. Подробнее мы поговорим об этом в главе по биоинформатике. Здесь отметим лишь несколько подходов.
Среди новых генов, обнаруженных в ходе полного секвенирования генома, сейчас осуществляют активный поиск тех, которые имеют структурное сходство с ранее выявленными генами- и белками-мишенями. Например, известной мишенью для лекарств являются белки, обладающие свойствами протеаз, — ферментов, расщепляющих другие белки. Сейчас уже предсказано существование у человека около 1000 белков с такими свойствами (вот и 1000 новых потенциальных мишеней!).
Другой подход — анализ все тех же уже многократно упоминавшихся снипсов. Изучение вариаций в геноме позволяет осуществлять направленный поиск генов, ответственных за определенные заболевания человека, которые ранее не рассматривались как гены-мишени.
С помощью компьютеров осуществляют также отбор среди имеющихся в распоряжении человека миллионов различных химических соединений тех, которые способны специфически взаимодействовать с определенными белками-мишенями, определяющими развитие того или иного заболевания.
Важнейшее направление в фармакогеномике — перевод медицины на рельсы персонифицированного лечения. К настоящему времени уже накопилось большое количество информации о генах, которые влияют на процессы всасывания, распределения, метаболизма и выведения лекарственных средств. В связи с полиморфизмом таких генов у некоторых пациентов лекарственные препараты могут быть неэффективными или даже оказывать токсическое воздействие. Известно, например, что в норме у различных групп исследуемых людей скорость удаления (элиминации) лекарства из организма может отличаться от 4 до 100 раз. Одним из комплексов генов, определяющих метаболизм лекарственных препаратов, являются гены системы цитохрома Р450. Скорость метаболизма лекарств у людей с разными изменениями этих генов отличается в сотни раз. Это указывает на то, что у отдельных индивидуумов возможно развитие побочных реакций в ответ на прием лекарственных препаратов даже в обычных (официально рекомендованных) дозах.
По данным Американской медицинской ассоциации, в США в 1994 году развитие побочных реакций явилось причиной госпитализации 2 млн. человек. В настоящее время почти семи миллионам американцев в возрасте 65 лет и старше прописываются лекарства, которые им не совсем подходят. Хуже того, по мнению экспертов, около одного миллиона проглоченных ими таблеток им вообще не следовало бы принимать. В последние годы побочные реакции на прием лекарственных препаратов постоянно занимают 4-е — 6-е место среди причин смерти в США. По некоторым оценкам, из-за неблагоприятных реакций на сильнодействующие лекарственные средства ежегодно в мире умирают до 100 тыс. человек.
Важное значение для решения этих проблем имеет изучение особенности структуры не только генов, детерминирующих метаболизм лекарственных средств, но и ряда других, на первый взгляд, совершенно незначительных различий, которые имеются в геномах разных индивидуумов. В частности, восприимчивость и реакция человека на те или иные лекарства в ряде случаев тесно связана с уже упоминавшимися снипсами. Так же, как эти «незначительные» вариации в геноме определяют разницу в подверженности людей к определенным видам заболевании, с ними зачастую ассоциированы и различия в результатах, наступающих у конкретного человека после принятия определенного лекарства. Приведем один пример. Астматики часто используют лекарство албутерол, который взаимодействует с рецептором адреналина и подавляет приступ удушья. Однако из-за разнообразия гаплотипов людей лекарство действует не на всех, а некоторым больным оно вообще противопоказано. Выяснилось, что это связано со снипсами в одном из генов: люди с последовательностью букв ТЦТЦЦ не реагируют на албутерол, если же концевой цитозин заменен на гуанин (ТЦТЦГ), то реакция есть, но частичная. Для людей же с тимином вместо концевого цитозина в этом участке — ТЦТЦТ — лекарство токсично!
Теперь фармацевтические компании планируют использовать все эти данные для производства определенных лекарств, предназначенных различным группам пациентов. В конечном итоге это поможет устранить побочные реакции от лекарств, точнее понять механизм их действия, а в результате снизить миллионные затраты. В частности, генотипирование лекарственной устойчивости сможет привести к более эффективной и безопасной химиотерапии у каждого конкретного пациента, больного раком. На практике лечение рака обычно носит эмпирический характер и основано скорее на клинических данных, чем на понимании механизмов чувствительности к химическим агентам. Например, для лечения раковых больных сейчас широко используется препарат цисплатин. Но он далеко не всегда оказывается эффективным. Проведенные исследования выяснили, что формирование резистентности к этому препарату обеспечивают два гена нашего организма — MGMT и MLH1 . Продукты этих генов в норме препятствуют развитию опухоли. У конкретного индивидуума данные гены могут не работать по ряду причин, например, в результате химической модификации, получившей название метилирование. Появление метильных групп в определенных участках этих генов приводит к их выключению (инактивации). Получая ДНК из сыворотки больных в ходе лечения, можно анализировать степень модификации вышеуказанных генов и таким образом определять целесообразность использования цисплатина для химиотерапии конкретных пациентов.
Другим примером использования фармакогеномики в клинике может служить изучение действия азотиоприна при лечении лейкемии и некоторых аутоиммунных заболеваний. Азотиоприн разрушается в клетках специальным ферментом. Если соответствующие гены работают плохо, то лекарство постепенно накапливается в организме и вызывает острые нарушения в костном мозге. Таким образом, из лекарства оно может превратиться в яд. В этих случаях рекомендуется или уменьшать его дозу, или использовать альтернативную терапию.
Наконец, такой показательный пример. Для лечения рака груди сейчас существует множество средств. Врач обычно на практике выбирает, порой чисто интуитивно, какое-то одно, а потом наблюдает за реакцией организма на их прием. Фармакогеномика обещает сделать выбор нужного препарата намного более быстрым и точным. Теперь известно, что около четверти пациенток с раком груди относится к уникальной генетической группе, обладающей так называемой «сверхвыраженностью Her2». Сделав несложный анализ для таких больных, врачи могут прописывать лекарство, специально разработанное для того, чтобы блокировать вредные белки, образующиеся в организме с этой генетической вариацией. Такой способ повышает выживаемость пациенток на 25 процентов.
По данным «Журнала американской медицинской ассоциации», почти семи миллионам пожилых американцев — примерно двадцати процентам живущих в стране людей в возрасте 65 лет и старше — прописываются лекарства, которые им не совсем подходят. Это еще один из аспектов фармакогеномики. Дело в том, что врачи подчас не учитывают возрастных изменений, происходящих в организме в процессе старения.
Не вызывает сомнения, что в результате обнаружения новых генов и последующего выяснения их точных функций будут созданы специальные тесты (например, в виде микрочипов) для определения персональных реакций организма на различные лекарственные препараты. Для разработки таких диагностических тестов в первую очередь необходимо обнаружить тот ген или тот «профиль» снипсов, который и позволяет предсказать реакцию организма на действие определенного лекарственного средства. Сравнение ДНКовых текстов пациентов с разной реакцией на одно и то же лекарство позволит также осуществлять поиск соответствующих генов без всякого знания об их участии в биохимических процессах.
Хотя разработанные в настоящее время тесты еще несовершенны, нет сомнения, что хорошие фармакогеномные тесты будут созданы в самые ближайшие годы. И тогда благодаря им появится возможность определить вероятность возникновения у конкретного человека побочных реакций, развивающихся в результате применения определенного лекарственного препарата или группы лекарственных средств. Для практического применения врачами таких тестов необходимо, чтобы они отвечали ряду требований: дешевизна, точность, простота в использовании.
Можно представить себе микрочипы недалекого будущего, на которые будут нанесены все известные гены, определяющие типы реакции на то или иное лекарственное средство. Это изменит полностью сам характер фармацевтической промышленности. Из изготовителей стандартной продукции и продавцов «универсальных» лекарств фирмы превратятся в поставщиков высококачественных медицинских услуг с выгодой как для себя, так и для экономики здравоохранения в целом. А конкретный пациент может оказаться в большем выигрыше за счет более точного назначения «индивидуальной пилюли» с улучшенными свойствами.
Нет сомнения, что фармакогеномика способна революционизировать процессы поиска генов и белков-мишений, а также создания лекарств и тестов на восприимчивость к ним, разработать схемы правильного применения различных медицинских средств. В широком смысле речь идет о создании на ее основе индивидуализированной (персонифицированной) медицины — медицины будущего. По словам доктора Сьюзен Хеллманн, руководящей медицинским отделом в биотехнической фирме Genentech, «это примерно то же, как если бы раньше мы работали топором, а сейчас собираемся заменить его на скальпель».
Согласно прогнозам американской консалтинговой компании «Front Line Strategic Management Consulting», к 2010 г. благадаря использованию фармакогеномики произойдет сокращение расходов на лечение больных в США приблизительно на 1 млрд. долларов. В результате применения тестов на снипсы для предварительного скрининга пациентов в отношении реакции организма на определенный лекарственный препарат более чем на 32 % повысится эффективность медикаментозного лечения и на 25 % сократится число побочных реакций.
Смерть и бессмертие — в наших генах (проблема долголетия)Компьютер вместо пробирки (геноинформатика)