Книга: Популярная библиотека химических элементов. Книга первая. Водород — палладий
Ближайший аналог лантаноидов
| <<< Назад ИТТРИЙ |
Вперед >>> От окисла к металлу |
Ближайший аналог лантаноидов
К числу «редких земель» иттрий отнесли не случайно. Всем своим обликом и поведением он подобен лантану и лантаноидам.
Иттрий легко растворяется в минеральных кислотах, кроме, как это ни странно, плавиковой. В кипящей воде он постепенно окисляется, а на воздухе при температуре 400°C окисление иттрия идет достаточно быстро. Но при этом образуется темная блестящая пленка окиси, плотно окутывающая металл и препятствующая окислению в массе. Лишь при 760°C эта пленка теряет защитные свойства, и тогда окисление превращает светло-серый металл в бесцветную или черную (от примесей) окись.
Как и многие лантаноиды, иттрий относится к числу довольно распространенных металлов. По данным геохимиков, содержание иттрия в земной коре 0,0028% — это значит, что элемент № 39 входит в число 30 наиболее распространенных элементов Земли. Тем не менее о нем до последнего времени говорили и писали как о перспективном, но пока «безработном» элементе. Объясняется это прежде всего чрезвычайной рассеянностью элемента № 39, что еще раз подчеркивает его «кровное родство» со скандием, лантаном и лантаноидами.
Минералов, в которых обнаружен иттрий, известно больше сотни. Он есть в полевых шпатах и слюдах, минералах железа, кальция и марганца, в цериевых, урановых и ториевых рудах. Но даже если примесь иттрия сравнительно велика — 1–5% (напомним, что медная руда, содержащая 3% Cu, считается очень богатой), извлечь чистый иттрий чрезвычайно трудно. Мешает сходство, прежде всего сходство с другими редкими землями и, более отдаленное — с кальцием, цирконием и гафнием, ураном и торием, другими «крупно-атомными» элементами (радиус ионов 0,8–1,2 A?).
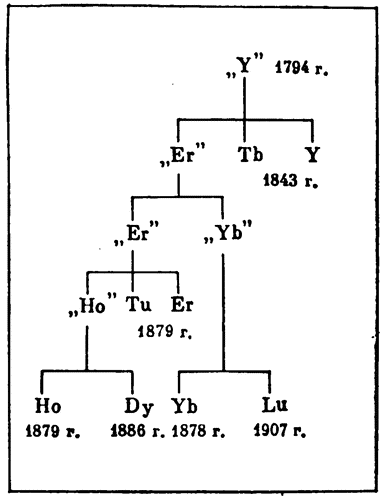
Окись иттрия, выделенная из гадолинита, в действительности оказалась смесью окислов нескольких элементов. Больше ста лет продолжалось «расщепление» иттрия на все новые и новые элементы. Основные этапы этого «расщепления» отражены на диаграмме
Иттрий плотно заперт в кристаллической решетке минерала и вырвать его оттуда далеко не просто. Правда, сейчас уже во многих странах налажено попутное извлечение иттрия при переработке цериевых, урановых и ториевых руд; как источник элемента № 39 используют бастнезит и некоторые минералы самого иттрия, прежде всего ксенотим. Но во всех случаях извлечение этого металла — дело трудное и долгое.
Вот как, к примеру, получают иттрий из ксенотима.
Казалось бы, просто. Формула минерала — YPO4. Давно известно, что лучше всего восстанавливать иттрий из его галогенидов. Значит, нужно провести обменную реакцию: вместо фосфата иттрия получить фторид или хлорид, а затем восстановить его. Всего две производственных стадии — чего проще!
Но просто все лишь на бумаге. В действительности в ксенотиме, уже обогащением на магнитном сепараторе, всего 36% Y2O3 (в виде фосфата) и 24% окислов других редкоземельных элементов. И здесь мешает ставшая уже притчей во языцех общность всех этих элементов.
«Вскрывают» минерал, обрабатывая его серной кислотой при высокой температуре. Полученный раствор подают на ионообменную колонну, заполненную катионообменной смолой. Избирательная способность катионита не слишком высока: он принимает почти все трехвалентные положительно заряженные ионы. Значит, на этой стадии иттрий отделяется лишь от «неродственных» элементов, а редкоземельные остаются в колонне вместе с ним.
Чтобы «смыть» иттрий с катионита, через колонку начинают пропускать элюент — раствор этилендиаминтетрауксусной кислоты. Такой «душ» полезен потому, что на этой стадии образуются комплексные соединения иттрия и других редких земель, отличающиеся одно от другого больше, чем классические соединения этих элементов, отчего ионы иттрия и ионы прочих редкоземельных элементов удерживаются катионитом с неодинаковой силой. Значит, в разных фракциях элюента будут преобладать уже разные элементы.
Отобрав иттриевую фракцию и подвергнув ее дополнительной очистке, на нее воздействуют щавелевой кислотой и получают оксалат иттрия. Его прокаливают, превращая в окись. Этим способом на 12 колоннах (высотой 3 и диаметром 0,75 м) за месяц получают чуть больше 100 кг Y2O3. Впрочем, считать месячную производительность неразумно: процесс длится два месяца. Выход 99,9%-ной окиси иттрия за два месяца — 225 кг.
Еще раз напомним, что описанная схема — одна из многих; чаще всего окись иттрия получают из бастнезита совсем другим путем.
Окись иттрия находит самостоятельное применение. Известно, что она, как и окись скандия, входит в состав ферритов — элементов памяти электронно-вычислительных машин.
| <<< Назад ИТТРИЙ |
Вперед >>> От окисла к металлу |
