Книга: Закон «джунглей»
Открытие обратной связи
| <<< Назад Глава 4. Жиры, обратная связь и чудесный грибок |
Вперед >>> «Пенициллин» для холестерина? |
Открытие обратной связи
Джо Голдштейн и Майк Браун познакомились в 1966 г., еще будучи интернами в Общеклинической больнице штата Массачусетс в Бостоне, где посменно дежурили в палате интенсивной терапии. Хотя Голдштейн вырос в небольшом городке в штате Южная Каролина, а Браун – в Нью-Йорке и Филадельфии, они сразу нашли общий язык. После длительных дежурств они, в отличие от других молодых врачей, подолгу обсуждали, какие патологии могут быть связаны с теми случаями, что им приходится наблюдать.
Отработав практику в Бостоне, оба перебрались в Национальные институты здравоохранения (NIH) в город Бетесда, штат Мэриленд, где стали клиническими наблюдателями, которые должны были не только заниматься исследованиями, но и вести пациентов. Голдштейн получил назначение в Национальный институт сердца. В самом начале работы ему попались двое особых пациентов – шестилетняя девочка и ее восьмилетний брат, оба ребенка страдали от сердечных приступов. Для Голдштейна это был настоящий момент истины.
Брат и сестра попали в больницу NIH, так как страдали заболеванием под названием «семейная гиперхолестеринемия». Эта наследственная болезнь встречается в двух формах. Первая, гетерозиготная, встречается примерно у одного из 500 человек. У таких людей есть одна копия мутантного гена, из-за которого уровень холестерина держится в диапазоне 300–400, сердечные приступы у них начинаются уже в возрасте около 35 лет. Совсем редко встречается гомозиготная форма, примерно один случай на 1 млн человек. Эти больные имеют две копии мутантного гена, у них совершенно астрономический уровень холестерина (около 800), и сердечные приступы у них начинаются уже в пятилетнем возрасте.
У брата с сестрой из Техаса была именно тяжелейшая гомозиготная форма. Голдштейн рассказал Брауну о детях, и они оба стали размышлять, какой дефект мог спровоцировать такой зашкаливающий уровень холестерина. Несмотря на то что оба были загружены работой в NIH, молодые врачи находили время на вечерние курсы по различным дисциплинам. На одном из этих курсов подробно обсуждались идеи Моно и Жакоба о регуляции. В университете Голдштейн и Браун выучили, что синтез холестерина подчинялся обратной регуляции: когда собак кормили пищей с высоким содержанием холестерина, синтез холестерина в организме угнетался. Может быть, предположили двое врачей, у пациентов с семейной гиперхолестеринемией нарушена обратная регуляция холестерина?
Тогда как большинство их талантливых сокурсников планировали сделать исследовательскую карьеру в онкологии, нейрофизиологии и других престижных дисциплинах, Голдштейн и Браун решили работать вместе и всерьез заняться изучением регуляции холестерина. «Это просто жирные капельки», – подначивали их приятели. Но Голдштейн и Браун игнорировали такие насмешки и, перебравшись в Юго-Западный медицинский центр при Университете Техаса, официально объединили свои лаборатории. Всего через два года, работая без выходных, они смогли приоткрыть тайну холестеринемии и понять логику регуляции холестерина, поставив ряд изящных экспериментов.
К тому моменту, как они начали свою работу, уже был расшифрован биохимический «путь», приводивший к образованию молекулы холестерина, содержавшей 27 атомов углерода, из молекул предшественника, в которых было всего по два атома углерода. Это достижение стало результатом серии открытий, за которые было присуждено в общей сложности 11 Нобелевских премий. Биохимический «путь» включал в себя около 30 ферментов, но было известно, что активность синтеза холестерина определяется на первом этапе «пути», где образуется вещество с длинным названием: 3-гидрокси-3-метилглютарил-кофермент А редуктаза. Я буду называть его просто редуктазой, так как это единственный фермент, о котором пойдет речь в этой главе, и в данном случае несущественно, как именно он работает. В данном случае, как и в предыдущем, важна сама логика регуляции.
Брауну и Голдштейну требовалось изучить активность редуктазы у человека, но, поскольку этот фермент действует в печени, поставить такие опыты на людях было бы сложно. Тогда они разработали способ наблюдения за ферментом в клеточных культурах, взятых у человека и выращиваемых в пробирке. Чтобы клетки росли в культуре, им требуются питательные вещества, обычно предоставляемые в виде сыворотки. Один из первых феноменов, открытых Брауном и Голдштейном, заключался в следующем: активность редуктазы подвергалась отрицательной регуляции со стороны какого-либо компонента сыворотки; в присутствии сыворотки активность снижалась, а при отсутствии сыворотки – десятикратно возрастала.
Тогда они захотели выяснить, какой компонент сыворотки подавляет активность редуктазы. Они полагали, что все дело в каком-нибудь липидосодержащем веществе, поэтому проверили активность ЛПНП (липопротеина низкой плотности), ЛВП (липопротеина высокой плотности) и фракций, не содержащих липидов. Оказалось, что именно ЛПНП, но не ЛВП и не другие фракции был мощным ингибитором активности фермента.
Исходя из логики и открытий Моно и Жакоба, Голдштейн и Браун предположили, что у пациентов с гиперхолестеринемией, страдавших избытком холестерина, могли возникать мутации в гене редуктазы, из-за которых этот фермент не поддавался регуляции со стороны ЛПНП. Первая серия экспериментов, казалось бы, подкрепляла эту версию. Когда клетки пациентов с семейной гиперхолестеринемией выращивались в культурах, Голдштейн и Браун отмечали, что активность редуктазы в этих клетках в 40–60 раз выше, чем в клетках здоровых людей, и что ЛПНП не влияет на активность фермента в них.
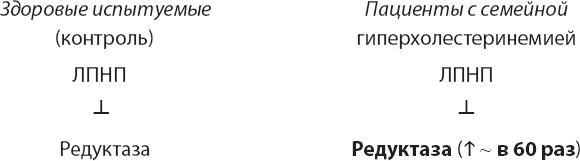
Но следующий эксперимент позволил отмести идею о том, что у пациентов с семейной гиперхолестеринемией изменяется редуктаза как таковая, зато подсказал иную возможность. ЛПНП – это структура, в состав которой входят и белки, и липиды, в том числе холестерин. Браун и Голдштейн предположили, что холестерин является действующим веществом, подавляющим активность фермента. Поэтому они стали «кормить» клетки холестерином, не содержавшим липопротеинов, и в результате обнаружили, что холестерин – действительно мощный ингибитор активности фермента в клетках здорового человека, но с удивлением заметили, что холестерин также снижает активность редуктазы в клетках пациентов, страдающих семейной гиперхолестеринемией. Таким образом, редуктаза у таких пациентов была не менее чувствительна к обратному контролю холестерина, чем у здоровых людей, за исключением случаев, когда холестерин присутствовал только в составе ЛПНП.
Поскольку дефект у пациентов с семейной гиперхолестеринемией был связан не с ферментом-редуктазой, причина должна была заключаться в чем-то ином, в каком-то факторе, о котором Голдштейн и Браун пока не знали. Поскольку холестеринсодержащий ЛПНП циркулирует вне клеток, возможно ли, что у пациентов с семейной гиперхолестеринемией была нарушена передача холестерина из внеклеточного ЛПНП в сами клетки?
Браун и Голдштейн предположили, что вне клеток может существовать специфический рецептор ЛПНП. Чтобы проверить эту идею, они поставили схожий эксперимент. Они снабдили частицы ЛПНП радиоактивными «метками», чтобы измерить, насколько активно они связываются с клетками. Выяснилось, что меченые частицы ЛПНП связывались именно со здоровыми клетками, но не с клетками, пораженными семейной гиперхолестеринемией. Этот эксперимент выявил специфичный рецептор ЛПНП в здоровых клетках, который, однако, отсутствовал в клетках пациентов с семейной гиперхолестеринемией. Действительно, в регуляции уровня холестерина участвовал еще какой-то фактор.
Браун и Голдштейн выяснили, как действует рецептор, доставляющий холестерин извне клеток в сами клетки. Белковая часть ЛПНП несет холестерин и пристыковывается к рецептору, затем молекулы холестерина внутри клеток отделяются от белка и, уже будучи в клетках, могут регулировать активность редуктазы. Открытие рецептора ЛПНП объясняло, почему циркулирующий ЛПНП не может регулировать синтез холестерина у больных семейной гиперхолестеринемией, а у здоровых людей – может.

Браун и Голдштейн также установили, что количество рецепторов ЛПНП на клетках подчиняется обратной регуляции так же, как и редуктаза: когда уровень холестерина в клетках низок, увеличивается количество рецепторов ЛПНП и активность редуктазы; когда уровень холестерина высок, количество рецепторов и активность редуктазы снижаются. Это абсолютно логично, поскольку клетки могут поддерживать стабильный уровень холестерина: когда уровень холестерина низок, клетки извлекают холестерин из кровотока, а также синтезируют его; когда холестерина достаточно, угнетаются как редуктаза, так и рецепторы ЛПНП.
Более 93 % всего холестерина в организме содержится в клетках, он для них жизненно важен. Но 7 % циркулирует в крови; примерно две трети от этой доли – в форме ЛПНП, треть – в форме ЛВП. Эпидемиологические исследования и опыты на животных показали, что именно циркулирующий в крови ЛПНП-холестерин («плохой холестерин») – основная причина образования бляшек и возникновения сердечных заболеваний. Можно ли было использовать в медицине открытия Голдштейна и Брауна о законах регуляции холестерина? Эти двое даже не подозревали, что семена медицинской революции уже посажены очень далеко от Техаса.
| <<< Назад Глава 4. Жиры, обратная связь и чудесный грибок |
Вперед >>> «Пенициллин» для холестерина? |
- Часть II. Открытие синхронизма
- Открытие Австралии
- Открытие Америки
- Регуляция по механизму отрицательной обратной связи и гормональные влияния на поведение
- § 39 Открытие радиоактивности и модель атома Резерфорда
- Открытие магнитаров
- Предсказание и открытие нейтронных звезд
- Я сделал открытие!
- Как сделать открытие?
- Второе открытие Марса
- ОТКРЫТИЕ ЭЛЕКТРОНОВ И КВАРКОВ
- ОТКРЫТИЕ КВАРКОВ
