Книга: Чудеса на выбор, или химические опыты для новичков
Глава седьмая. Электрические чудеса
| <<< Назад Глава шестая. Сладкие чудеса |
Вперед >>> Помещенные здесь фотографии введут тебя в мир химической лаборатории |
Глава седьмая. Электрические чудеса
Так уж повелось с древних времен, что чудес должно быть ровно семь. Шесть вроде бы мало, а восемь — уже излишек.
Не станем спорить: семь так семь. Значит, эта глава будет в книжке последней. А к концу положено приберечь что-нибудь этакое…
Пусть это будут химические чудеса с участием электричества. Нет-нет, током тебя не ударит: более того, мы даже и близко не подойдем к электрической розетке. Нас вполне устроят батарейки для карманного фонарика.
Между прочим, знаешь ли ты, почему батарейки дают ток? Потому, что в них происходит химическая реакция. Про батарейки говорят, что они химические источники тока. Но если так, то не могут ли под действием тока идти какие-то необычные превращения? Могут. Наука, которая изучает такие превращения, носит название электрохимии. С помощью электричества в лабораториях и на заводах получают новые вещества, растворяют металлы, наносят один металл на другой, очищают воду. Словом, делают десятки и сотни полезных химических чудес.
Займемся тем же.
Для электрических чудес требуются:
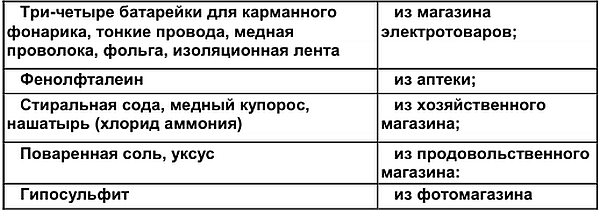
Как я уже говорил, сильный ток нам не нужен. Но не помешало бы научиться, как обнаружить слабый и очень слабый электрический ток.
Есть такой нехитрый способ: лизнуть одновременно оба контакта батарейки. Сразу на языке появляется кислый вкус. Чем он кислее, тем лучше батарейка заряжена. Совсем не кислый — батарейка негодная.
Но я этот способ никак не могу советовать. Во-первых, на контактах может оказаться грязь, а лизать языком неведомо что — ты ведь не какой-нибудь несмышленыш. Во-вторых, если батарейка совсем новая, то ощущение может оказаться довольно острым. Лучше поступить иначе. И кстати, результат будет нагляднее.
В майонезную банку налей воды, насыпь чайную ложку поваренной соли, размешай, пока она не растворится, и прибавь несколько капель раствора фенолфталеина. Закрой банку пластмассовой крышкой с двумя отверстиями (их можно, например, заранее проколоть шилом). В отверстия продень медные проволочки — так, чтобы они были погружены в раствор, но не соприкасались одна с другой. Это — прибор для обнаружения тока. Проверь его в работе. Присоедини проволочки к полюсам батарейки — ток сразу выдаст себя: у одной из проволочек раствор станет малиновым. Там из поваренной соли образовалась щелочь.
Но этот прибор умеет еще кое-что. Он может распознать, где у батарейки положительный полюс, а где — отрицательный. (Они всегда отмечены так: положительный полюс — знаком «+» отрицательный — знаком «—».) Обратил ли ты внимание, у какой проволочки раствор окрасился? Сколько ни повторяй опыт, малиновый цвет появляется у проволочки, соединенной с отрицательным полюсом. То есть с тем, где на батарейке нарисован «минус».
Чтобы не готовить каждый раз раствор заново, можно поступить и так: смочить им полоску фильтровальной бумаги или промокашки и пальцами прижать полоску к обоим полюсам батарейки. Возле отрицательного полюса бумажка покраснеет. Это очень удобно, когда нужно знать, где «плюс», где «минус», а обертка батарейки порвалась или испачкалась так, что ничего не разобрать. Имея такой индикатор электричества, можешь переходить к дальнейшим опытам. Сначала с помощью простейших средств попробуй сделать настоящий химический источник тока. Или, говоря проще, самодельную батарейку.
Тебе понадобится немного «серебряной» бумаги: у нее одна сторона действительно бумажная, а другая из металла, обычно из алюминия; «серебряная» она только с виду. В такую бумагу заворачивают чай и сигареты; ее продают иногда в магазинах для разных самоделок. Нарежь эту бумагу на кружки размером чуть меньше пятака. А заодно запасись и самими пятаками — обычными медными монетами. Ты их не испортишь: после опыта они будут ничуть не хуже, чем прежде.
Нарезанную «серебряную» бумагу смочи как следует раствором поваренной соли. Пока она намокает, начисти до блеска десяток медных пятаков. А потом собери из бумажных кружков и пятаков стопку в такой последовательности: сначала «серебряная» бумага (бумагой вниз, «серебром» вверх), потом пятак, потом опять бумага и так далее; сверху окажется последний пятак. Возьми два гибких провода длиной сантиметров по двадцать и с концов аккуратно сними ножом изоляцию, чтобы обнажить медные жилки. Один провод положи под стопку, другой — на стопку и плотно примотай изоляционной лентой, чтобы медные жилки были хорошо прижаты: одна — к бумаге, другая — к верхнему пятаку. Батарейка готова.
Боюсь, что лампочка от такой батарейки все же не загорится. Но если соединить проводки с банкой-индикатором (или если приложить к ним смоченную раствором полоску промокашки), то через минуту-другую появится красная окраска. А это значит, что батарейка работает. Где у нее положительный полюс, где отрицательный, сам разберешься.
Если удастся вырезать кружки размером с пятак из алюминия, можно сделать более мощную батарейку. Между пятаками и алюминиевыми кружками клади промокашку, смоченную раствором соли; внизу, как и прежде, пусть будет бумага, вверху — пятак. Провода и изоляционная лента, конечно, тоже нужны.
Настоящая батарейка, хотя в ней совсем другие вещества, работает по тому же принципу. В ней есть положительные пластины и отрицательные пластины, а между ними какой-нибудь раствор, способный проводить электричество (как раствор соли). Каждые две пластинки — это электрический элемент. А много элементов — батарея. Наша состоит из десяти элементов. Батарейка для карманного фонарика содержит обычно три элемента. Можешь расковырять старую батарейку: в ней три металлических стаканчика.
Если уж ты добрался до стаканчика, то аккуратно разломай его и достань изнутри густую массу, которая окружает угольный стерженек. Эта масса состоит в основном из диоксида марганца. В старых батарейках она бывает обычно почти сухой. Соскреби ее, подсуши, разотри в порошок и добавь немного какого-нибудь клея. Намажь этой смесью листок «серебряной» бумаги со стороны металла и дай высохнуть, а потом нарежь бумагу на прямоугольники размером со спичечный коробок. Сложи из прямоугольников стопку таким образом, чтобы внизу была бумага, в середке — металл, а сверху — намазка. Приложи к стопке сверху и снизу проводки, обмотай изоляционной лентой и положи все вместе в спичечный коробок, оставив снаружи только проводки. Это — еще один вариант батарейки. Проверь ее. Может случиться, что ты пересушишь намазку, и тогда батарейка работать не будет. В таком случае ее либо надо подержать недолго над паром, чтобы она набрала влаги, либо можно слегка увлажнить пасту раствором соли или нашатыря (хлорида аммония).
Самодельные батарейки дают маленький ток. Но если сделать несколько батареек, проверить их и соединить медными проволочками, тогда, вполне возможно, от такой объединенной батареи загорится маленькая лампочка и заработает микродвигатель от самоходной игрушки. А соединять надо параллельно. То есть положительные полюса с положительными, отрицательные — с отрицательными (надеюсь, ты не забывал помечать их знаками «+» и «—»).
Теперь я дам тебе совет, как заставить работать старую батарейку, которой, казалось бы, пришел конец. Может случиться так, что батарейка приемника «сядет» как раз во время интересной передачи. Или фонарик погаснет в сумерки…
Не спеши выбрасывать батарейку. Ее можно оживить. Большинство батареек — и для карманного фонарика, и для приемника — содержат известный тебе диоксид марганца в цинковом стаканчике. Со стаканчиком почти ничего не случается, а диоксид довольно быстро покрывается скорлупой из веществ, которые мешают электрохимической реакции. Вот если бы эту скорлупу разрушить…
Так разрушим вредную оболочку вокруг полезного вещества. Самый простой способ: постучи по батарейке молотком или камнем. Не очень сильно, чтобы не сломать ее, но и не очень слабо, чтобы все же разрушить скорлупу. Батарейка оживет, пусть и не надолго.
Есть способ оживления и понадежнее. Возьми гвоздь и молоток, пробей гвоздем отверстие в цинковом стаканчике (имей в виду, что в круглых батарейках только один стаканчик). А потом опусти батарейку в воду. Паста размокнет в воде, ей легче будет проникнуть к зернам диоксида марганца. Так можно продлить жизнь батарейки примерно на треть.
А если есть время, терпение и трансформатор для детской железной дороги, то старую батарейку можно зарядить заново. Но только в том случае, если она не повреждена, а паста внутри не полностью высохла. В таком случае с помощью банки-индикатора определи, где «плюс», а где «минус» у твоего трансформатора (это не опасно, напряжение небольшое), соедини «плюс» с «плюсом» батарейки, «минус» — с «минусом» и оставь на час-другой для зарядки. Поглядывай, чтобы на приборе не загорелась красная лампочка. Если она зажжется, сразу отключай прибор: в батарейке произошло замыкание, зарядить ее уже невозможно.
Для дальнейших опытов нужны заведомо хорошие батарейки, новые или своими силами восстановленные. Удобнее работать с плоскими батарейками (для карманного фонарика). В следующем опыте их понадобится две, причем соединенные последовательно — «плюс» одной к «минусу» другой.
Возьми две полоски любого металла длиной сантиметров десять. Можешь вырезать их, например, из жести или из тонкого алюминия. С одной стороны проделай в пластинках небольшие отверстия и продень в них провода. Если провода с изоляцией, то не забудь счистить ее в том месте, где они соприкасаются с металлом.
Опусти пластинки в небольшую банку, скажем из-под майонеза. Расстояние между ними должно быть небольшим, несколько миллиметров. Чтобы они не соприкасались, положи сверху и снизу по комочку пластилина. Подвесь пластинки прямо на проводках, а как закрепить их — придумай, пожалуйста, сам.
Налей в банку воду, закрашенную любыми чернилами, чтобы жидкость была непрозрачной. Присоедини проводки к батарейкам. Спустя минуту-другую жидкость между пластинками начнет понемногу светлеть. На дне посреди банки соберутся темные частички. А наверху образуется грязноватая пена.
В состав чернил входят очень мелкие частички красителя. Под действием электричества они объединяются, слипаются. Тяжелые частицы, понятное дело, опускаются на дно. Но некоторые из них всплывают наверх вместе с пузырьками пены: их подхватывает газ, который образуется из воды под действием электрического тока.
Вот так электричество может очищать грязную воду. Правда, этот процесс очень дорогостоящ, поэтому применяют его в исключительных случаях. Но что это за газ из воды? И что вообще происходит с водой под действием тока?
Узнаем все это из опыта. В толстостенный стакан вставь в нескольких сантиметрах от дна вырезанный из фанеры кружок с двумя круглыми прорезями как раз такой ширины, чтобы в них плотно входил простой карандаш. Рядом с прорезями проколи шилом два маленьких отверстия, в которые могут войти тонкие изолированные проводки. Вставь в прорези две половинки хорошо очиненных карандашей. На другом их конце, неочиненном, сделай ножом зарубки, чтобы показался грифель, и намотай оголенные концы проводов. Медные жилки должны плотно прилегать к грифелю. Обмотай их изоляционной лентой, а если у тебя есть резиновая трубка, то натяни ее сверху, чтобы изоляция наверняка была надежной.
Вставь кружок в стакан таким образом, чтобы очиненные концы карандашей торчали вверх (но не выше края стакана), поставь это сооружение на тарелку и налей до краев раствор стиральной соды (две чайные ложки на стакан воды). В две пробирки или в высокие пузырьки налей такой же раствор. Возьми одну пробирку, закрой ее пальцем, переверни и опусти в стакан. Под водой надень пробирку на карандаш. Поступи так же со второй пробиркой.
Соедини последовательно три батарейки («плюс» одной — к «минусу» следующей), а к крайним батарейкам подсоедини проводки, идущие от карандашей. Прибор включен. Стакан, говоря строго, называется электролитической ванной, раствор соды — электролитом, карандаши — электродами, а то, что происходит в ванне, — это электролиз. Но что там происходит?
В воде находятся заряженные частицы водорода. Они движутся к положительному электроду. И возле того карандаша, который присоединен к «плюсу» батарейки, поднимаются вверх пузырьки водорода. А у второго карандаша появляются пузырьки другого газа — кислорода.
Когда соберется полная пробирка водорода (он вытеснит почти всю воду), аккуратно вынь ее из раствора и, не переворачивая, поднеси спичку: водород вспыхнет и хлопнет, как хлопушка. А пробирку с кислородом прикрой под водой пальцем, извлеки, переверни и опусти в нее погасшую, но еще тлеющую лучинку: в присутствии кислорода она вновь разожжется.
Получается, что вода под действием электричества разлагается на водород и кислород. Это ее свойство нередко используют для получения газа водорода (а кислорода и в воздухе достаточно).
Но зачем класть соду? Просто для ускорения опыта. Вода очень плохо проводит электричество, и без соды наш опыт слишком бы затянулся.
С тем же прибором повтори опыт еще раз, взяв вместо соды поваренную соль. В одной пробирке, как и прежде, появится водород, а в другой — желтозеленый газ хлор. Помнишь, как называется на химическом языке поваренная соль? Хлоридом натрия.
Вообще-то хлор довольно ядовит, но ты получаешь его в очень малом и безопасном количестве. Пробирку с хлором и остатками раствора соли закрой пальцем, вынь из воды, переверни и встряхни несколько раз. В пробирке — хлорная вода, очень сильный окислитель. Чтобы убедиться в этом, добавь эту воду к слабому чернильному раствору — он сразу обесцветится.
Возле отрицательного электрода капни немного раствора фенолфталеина. Он покраснеет. Значит, получилась еще и щелочь. Действительно щелочь, причем сильная и часто употребляемая — едкий натр. Выходит, что под действием тока раствор обычной соли дает сразу три полезных вещества — водород, хлор и едкий натр. Поваренная соль, которую мы все ценим как необходимую приправу к пище, не менее высоко ценится и в промышленности: это очень важное сырье.
Теперь мы поставим еще один опыт с раствором поваренной соли. Правда, для промышленности он значения не имеет, зато выглядит гораздо красивее, чем предыдущий. Собственно, он мало чем от него отличается. Только вместо грифельных электродов, из простого карандаша, возьми на этот раз медные электроды. Ими могут быть тонкие медные пластинки, а еще проще вырезать два прямоугольника из медной фольги.
Красные медные прямоугольники поставь вертикально по краям небольшой пластмассовой ванночки или эмалированного поддона. Налей в ванночку раствор поваренной соли (соотношение воды и соли особого значения не имеет); пусть этот раствор покроет прямоугольники чуть больше, чем наполовину. Затем двумя проводками присоедини медные электроды к положительному и отрицательному полюсам батарейки для карманного фонарика. Опыт начался.
Следи за тем, что происходит в твоей электролитической ванне. Сначала, как и в прошлом опыте, возле обеих пластинок появляются маленькие пузырьки газа. Правда, на этот раз хлор не образуется — у обоих электродов выделяется водород. А щелочь у отрицательного электрода можно обнаружить и теперь. Но самое интересное впереди.
Минут через пять или десять в жидкости появятся зеленые хлопья. Это из хлорида натрия образовался (но не сразу, а по целой цепочке превращений) зеленый хлорид меди. Однако и это еще не все.
Оставь прибор включенным и вернись к нему примерно через час. Ты увидишь, что раствор пожелтел, а на дне появился желтый осадок. Щелочь, которая появилась у электрода, вступила в реакцию с одним из соединений меди и образовала очень тонкий осадок, который постепенно меняет цвет с желтого на красный. Такая перемена цвета еще быстрее происходит при нагревании, но оно в данном случае необязательно, потому что наш электролит немного нагревается сам по себе, под действием электрического тока. В конце концов красный осадок смешивается с желтым, образуя коричневатую массу на дне ванночки.
Может случиться так, что этот опыт не пойдет до конца, и превращения прервутся где-то на середине. Скорее всего причина в том, что батарейка «села» во время работы. Боюсь, что оживлением ей уже не вернуть былой силы, которая для этого опыта просто необходима. Поэтому замени старую батарейку свежей.
И еще одно наблюдение, которое я советую тебе сделать. Рассмотри внимательно оба электрода после опыта. Они покроются налетом: один — черным, другой — зеленоватым. Такие цветные пленки на меди мы с тобой поучимся готовить специально, но сделаем это немного позже.
В очередном опыте с электричеством мы будем растворять металл. Но поскольку такое занятие само по себе не очень осмысленно, то давай поступим так: будем растворять металл в определенном месте, чтобы в куске металла получилось сквозное отверстие. Иными словами, будем сверлить металл с помощью электрического тока.
Приготовь насыщенный раствор поваренной соли и налей его в блюдечко. Положительный полюс батарейки соедини проводком с какой-нибудь тонкой металлической пластинкой, например с лезвием бритвы. Последи, чтобы проводок плотно прилегал к металлу. Возьми карандаш с зарубкой и проводком из опыта с поваренной солью, присоедини проводок к отрицательному полюсу батарейки. Обломай заточенный грифель у карандаша и иголкой проковыряй его чуть глубже, чтобы образовалась выемка глубиной с полмиллиметра. Лезвие положи в блюдце с раствором соли и коснись металла карандашом.
Как только обломанный грифель приблизится к бритве, появятся пузырьки водорода. А лезвие начнет растворяться. И минут через десять в нем образуется сквозная дыра. Если же вместо бритвы положить в блюдце алюминиевую фольгу да взять новую батарейку, то отверстие появится через считанные секунды.
Опыт можно несколько видоизменить — не класть бритву или фольгу в блюдце с раствором, а оставить их в сухом месте. Но тогда придется обмакивать карандаш в соль, а на то место, где будет отверстие, придется капать воду. Время от времени надо протирать металл чистой тряпочкой и наносить новую каплю воды. Жесть от консервной банки сверлится таким способом достаточно быстро. А металл потолще требует более сильного тока. Что ж, в таком случае возьми не одну, а две или даже три батарейки, соединенных параллельно («плюс» к «плюсу»). И не забудь очищать лунку, а потом капать свежую воду и обмакивать карандаш в соль.
И еще одно электрохимическое сверло: из медицинского шприца с иголкой. В шприц набери раствор поваренной соли. В тарелку поставь перевернутый стакан, на его дно положи бритву или какую-нибудь пластинку, присоединенную к «плюсу» батарейки, а к «минусу» батарейки прицепи вторую проволочку. Другой ее зачищенный конец обмотай вокруг иголки шприца. Потихоньку надавливай на поршень, и тонкая струйка раствора с помощью тока быстро просверлит металл.
Теперь покроем один металл слоем другого металла. Например, белое железо красной медью.
Погоди-ка, ты уже опускал гвоздь в раствор медного купороса, и он становился красным от меди. Так зачем ток?
Затем, что без него слой меди на железе получается рыхлым, непрочным: проведешь по нему тряпкой — он и слезает. А нам надо, чтобы металл долго держался на металле. Меднение и другие подобные операции на заводе обычно проводят в ваннах, в которые наливают подходящий раствор и опускают деталь под током. Но не всегда такое возможно. Как быть, если надо покрыть металлом корабельную обшивку? В таких случаях придумывают специальные устройства. Вроде того, которое ты сейчас сделаешь.
Испорченную авторучку (не шариковую, а ту, что пишет чернилами) разбери и гвоздем вытолкни устройство, в котором держится перо. В баллон для чернил набери крепкого раствора медного купороса. С мягкого многожильного провода сними изоляцию, пучок проводков вставь плотно туда, где некогда находилось перо. Приспособление для рисования медью готово. Займемся тем, на чем рисовать.
Любую металлическую пластинку, лучше стальную, надо начистить до блеска наждачной бумагой, вымыть и положить в раствор стиральной соды, который должен покипеть несколько минут, чтобы на поверхности пластинки не осталось грязи. Потом еще раз промой ее чистой водой и присоедини пластинку проводком к отрицательному полюсу батарейки. Торчащий из авторучки пучок проводков соедини с положительным полюсом — и за работу.
Води не торопясь «пером» по пластинке, и она на глазах будет покрываться слоем меди. Поглядывай, чтобы проводки были смочены жидкостью. Когда жидкость будет на исходе, набери новую порцию раствора медного купороса; впрочем, для простоты можешь время от времени обмакивать перо в раствор. Но в любом случае следи за тем, чтобы проводки не касались пластинки: между ними всегда должен быть слой жидкости.
Если покрывать красным металлом гвоздь или вязальную спицу, то времени уйдет немного и одной батарейки вполне хватит. На пластинку времени требуется побольше, и одной батарейки может оказаться недостаточно. Что ж, возьми две последовательно соединенные батарейки («плюс» к «минусу»); третья будет уже ни к чему. Когда слой меди нанесен, высуши пластинку и натри ее хорошенько мягкой шерстяной тряпкой. Медь заблестит, как умеет блестеть надраенная медь.
Но медь сияет до поры до времени. Старые медные и бронзовые предметы (а бронза содержит медь) покрываются зеленым налетом. Иногда от него стараются избавиться, а иногда, напротив, оберегают. Например, на старинных статуях.
Если хочешь, можешь сделать налет старины не за год и не за месяц, а за час-другой.
И тоже с помощью электрического тока.
Возьми кусок медной фольги или покрытую медью пластинку из предыдущего опыта. Присоедини проводок (если имеешь дело с фольгой, то проткни в ней отверстие для проводка), положи в раствор соды и прокипяти. Промой водой и опусти в слабый раствор уксуса, чтобы чистая медная поверхность не окислялась на воздухе. В стакане с водой размешай до растворения две чайные ложки нашатыря (хлорида аммония). Вынь пластинку из уксуса за проводник и промой под струей воды, стараясь не трогать медь руками. Опусти в раствор нашатыря и соедини проводник с положительным полюсом батарейки. К отрицательному полюсу присоедини проводком любой другой медный предмет, необязательно такой же чистый. Вскоре пластинка покроется матовым красным слоем. Минут через пять извлеки ее за проводок и, не касаясь руками, подвесь над столом. Внизу подставь тарелку или поддон, чтобы остатки раствора не капали на стол. Час спустя красный слой станет изумрудно-зеленым. Такой зеленый налет называют патиной. Или даже благородной патиной.
Когда патина образуется медленно, десятилетиями и веками, то и держится она долго. Мы получили ее за час, и жизнь ее исчисляется часами. Чтобы сохранить патину подольше, покрой ее каким-нибудь бесцветным лаком (например, нитролаком). За век не поручусь, но год жизни обещаю…
Це только патина придает изделиям из металла благородный оттенок старины. Почерневшее со временем серебро тоже выглядит очень красиво, и ценители искусства никогда не позволят надраить серебряное украшение до блеска: пусть на нем останется чернь. Более того, на некоторые изделия, особенно на чеканные, чернь наносят специально, чтобы детали казались более отчетливыми и рельефными.
Конечно, нам никто не разрешит экспериментировать с драгоценным серебром, да мы и сами не станем этого делать: мало ли что может случиться с украшением! А почернить можно и медные, и латунные, и бронзовые предметы. Если ты сам или кто-то из твоих знакомых увлекается чеканкой, можно покрыть чернью чеканное украшение. Впрочем, для опыта годится любая медная или латунная пластинка.
Состав чернящего раствора очень прост: 5 г гипосульфита натрия (из фотомагазина) раствори примерно в столовой ложке воды и добавь чуть больше половины столовой ложки обычного 9-процентного уксуса. Не удивляйся, обнаружив в этом растворе желтую мутную взвесь. Так и должно быть, потому что под действием уксуса из гипосульфита высвобождается содержащаяся в нем сера.
Возьми кастрюльку такого размера, чтобы твоя медная Или латунная пластинка лежала на ней, опираясь краями. Налей в кастрюлю воду, вскипяти ее и положи вместо крышки пластинку, тщательно вымытую со стиральным порошком. Теперь пар, подымающийся над кипящей водой, будет все время нагревать пластинку, и она довольно скоро почернеет, если ты смажешь ее приготовленной раньше желтоватой смесью. Время опыта подбери сам: чем оно больше, тем гуще получается окраска. Может случиться так, что цвет будет скорее коричневым, нежели черным. Это значит, что нужно немного увеличить в исходной смеси количество гипосульфита и уксуса (или уменьшить количество воды).
Объяснение этой реакции очень просто: медь вступает во взаимодействие с серой, в результате образуется черное вещество, называемое сульфидом меди. Когда это соединение получено, надо снять почерневшую пластинку с кастрюльки и остудить ее, а потом протереть чистой тряпкой с каким-нибудь чистящим средством для посуды или хотя бы с зубным порошком. Это очень полезная операция, потому что она позволяет удалить излишек черноты и высветлить выпуклые участки, от чего рисунок становится ясным, объемным.
После такого осветления полезно отполировать предмет мягкой тканью с какой-нибудь полировочной жидкостью, но это уже на твое усмотрение. Если ты просто хотел познакомиться с чернением, то можно и не полировать. Если же решил сделать красивую вещь еще более нарядной, то вряд ли надо жалеть время на то, чтобы довести ее, как говорится, до полного блеска.
В следующем опыте сделаем с помощью электрохимии какую-нибудь вещицу прямо из раствора. Это называется гальванопластикой. Она очень полезна в тех случаях, когда у детали очень сложная форма и сделать ее другими способами никак не удается. Скажем, копию с грампластинки — как в точности передать форму бороздок, незаметную даже глазу?
Грампластинку нам с тобой, пожалуй, не скопировать. А сделать какой-нибудь узор или монограмму, то есть свои инициалы, — это пожалуйста.
Возьми кусочек воска или парафина от свечки, разгладь поверхность как следует; возможно, придется слегка его подогреть в теплой воде. На гладком участке процарапай тонкой иглой неглубокий рисунок: узор, буквы — что тебе угодно. Извлеки грифель из простого карандаша и растолки его как можно мельче. Мягкой кисточкой нанеси грифельный порошок на рисунок. К поверхности, покрытой графитом, прижми по краям две тонкие медные проволочки и соедини их между собой. Подвесь этот слепок в стакане или в банке. Удобнее будет положить на край сосуда карандаш или палочку и к ним уже подвесить слепок — на нитке или на соединенных вместе проволочках. А по обе стороны от него подвесь две любые медные пластинки, хотя бы кусочки медной фольги. Проволочки от них соедини с «плюсом» батарейки, проволочки от слепка, покрытого графитом, — с «минусом».
Влей в сосуд раствор медного купороса (столовая ложка на стакан воды) и займись, пока суд да дело, чем-нибудь другим. Медь будет осаждаться часов пять, а то и больше. Можно бы и скорее, но тогда ее слой окажется непрочным. Поэтому наберись терпения. Больше одной батарейки тебе не понадобится, а если она не очень новая — тоже не беда…
Спустя несколько часов отсоедини проводки от батарейки и осторожно вынь восковой или парафиновый слепок. Аккуратнейшим образом опусти его в горячую воду. Податливый материал расплавится, а в руках у тебя окажется тонкий медный узор. Оторви его от проволочки — и опыт закончен.
А вместе с ним закончена книжка. Потому что это чудо было самым последним. Не вообще, а из тех чудес, которые предоставлены тебе на выбор. Если же тебе показалось, что их мало, — возьми другие книжки, полистай научно-популярные журналы, загляни в школьный учебник. Это всех только порадует. А ты сам станешь лишь еще умнее.

Химическая лаборатория для новичков закрывается. Хотя бы по той причине, что человек, проделавший столько опытов, никак не может считать себя начинающим химиком. Конечно, rw «в крупный знаток веществ и их превращений — до этого пока далеко. Но ведь и не новичок!
Так что на прощанье говорю с полным основанием: „До свидания, дорогой юный химик".
А еще не мешает почаще говорить „спасибо".
Так вот — спасибо всем, кто делал эту книжку.
А делали ее химики — ученые, инженеры, учителя. Надеюсь, ты не подумал, будто автор придумал все эти опыты сам, в одиночку? Правда, он собрал их вместе под одной обложкой — ему за них и отвечать, если что-то напутано или пропущено.
Делали ее и редакторы: они старались, чтобы книга была понятной, не слишком длинной, но и не очень короткой.
Рецензенты, ученые люди, заметили все неточности, а то и оплошности.
Корректоры, знатоки русского языка, следили внимательно, чтобы, например, слово «уксус» всюду было написано через два «у», а слово «порошок» — через три «о».
Старался фотограф, старались и художники…
Наборщики набирали текст, печатники печатали…
Всем этим людям — большое спасибо.
И ещё большое спасибо — тебе. За то, что ставил опыты, учитывал пожелания и не пренебрегал советами. За внимание и аккуратность. За то, что ты дочитал книжку вот до этой, прощальной страницы. И надо думать, прочтешь еще немало других книг — в том числе и по химии…

| <<< Назад Глава шестая. Сладкие чудеса |
Вперед >>> Помещенные здесь фотографии введут тебя в мир химической лаборатории |
- Предисловие первое: для родителей
- Предисловие второе: для старших братьев,
- Предисловие третье: для вас, юные химики
- Глава первая. Чудеса для разминки
- Глава вторая. Разноцветные чудеса
- Глава третья. Полезные чудеса
- Глава четвертая. Поучительные чудеса
- Глава пятая. Летние чудеса
- Глава шестая. Сладкие чудеса
- Глава седьмая. Электрические чудеса
- Помещенные здесь фотографии введут тебя в мир химической лаборатории
- Приложения
- Сноски из книги
- Содержание книги
- Популярные страницы
- Чудеса на выбор, или химические опыты для новичков
- Электрические разряды рыб
- Чудеса острова Мадагаскар
- Чудеса в стеклянной банке
- Электрические рыбы и бионика
- Электрические рецепторы рыб
- 9. Электрические импульсы: как нервничать без нервов
- Электрические поля — средство общения рыб
- Чудеса наших субтропиков
- Электрические явления в клетке
- 15. Редкости и чудеса
- Магнитные, электрические и гравитационные поля
