Книга: Что, если Ламарк прав? Иммуногенетика и эволюция
Структура антител
| <<< Назад Эволюция иммунной системы |
Вперед >>> Что происходит при заражении? |
Структура антител
Теперь кратко рассмотрим структуру молекулы антитела. Все антитела имеют общий план строения — это белки, состоящие из нескольких субъединиц. На рис. 3.2 показано строение наиболее обычного антитела, называемого IgG. Эта структура была впервые описана в 1960-е годы в лаборатории Джералда Эдель-мана (Edelman) и Родни Портера ( Porter), которые были удостоены Нобелевской премии в 1972 г. Антигенсвязывающий центр состоит из вариабельных (V) областей тяжелой (Н) и легкой (L) белковых цепей, объединенных в HL-гетеродимер. Каждая молекула антитела состоит из двух идентичных HL ге-теродимеров, кроме пентамера IgM, у которого десять HL-гете-родимеров (рис. 3.2 и 3.5). Константная (постоянная) С-область молекулы запускает лизис (разрушение) или фагоцитоз (поглощение фагоцитом) чужих бактериальных клеток и частиц после связывания с ними антитела (рис. 3.1).
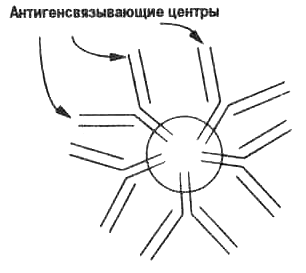
Рис. 3.5. Строение пентамерной молекулы IgМ антитела, состоящей из 10 HL-гетеродимеров (5 мономеров молекулы IgМ). Подробности в табл. 3.1. Каждый антигенсвязывающий центр имеет невысокую аффинность, но связывание во многих центрах увеличивает среднюю авидность антитела (см. рис. 3.7).
По правилам традиционной генетики для кодирования Н-цепи антитела нужен один ген, а для кодирования L-цепи — другой. Достаточно ли в нашем геноме ДНК для кодирования всех специфичных антител (скажем, миллиона)? Этот важный вопрос был поставлен в 1960-е годы Мелвином Коном (Cohn) и другими учеными сразу после расшифровки генетического кода. Этот вопрос и проблема механизма аутотолерантности заставили усилить внимание к стратегии, которой должна следовать иммунная система при создании того разнообразия связывающих антигены рецепторов, которое необходимо для борьбы с инфекционными заболеваниями. Стратегия ли это «зародышевой линии», при которой все специфичные антитела закодированы в яйцеклетках и сперматозоидах? Или же иммунная система использует особую «соматическую» стратегию, при которой гены в лимфоцитах мутируют или случайно рекомбинируют, образуя дополнительное разнообразие в репертуаре HL-центров?
В 1960-е и начале 1970-х годов среди ученых, придерживающихся этих двух принципиально различных мнений, происходили кратковременные, но частые теоретические сражения. Тем не менее к концу 1970-х годов благодаря молекулярно-ге-нетаческим работам Сусуми Тонегава (Tonegawa), получившего в 1987 г. Нобелевскую премию, эта проблема была в основном решена. Сейчас мы знаем, что часть разнообразия создается генами зародышевой линии, но случайные соматические процессы (рекомбинация и мутация) также необходимы для образования гигантского разнообразия антител и рецепторов Т-клеток. То есть, в течение жизни наш организм «учится» бороться с многочисленными захватчиками и создает в лимфоцитах много новых ДНК-последовательностей, кодирующих антитела. Далее мы обсудим данные, указывающие на то, что ДНК-последовательности из лимфоцитов могут быть включены в половые клетки и переданы следующим поколениям.
Теперь мы конкретизируем основные элементы проблемы создания репертуара антител и молекулярные детали иммунного ответа. Тяжелая цепь каждого антитела представляет собой белок, состоящий примерно из 400 аминокислот (100 в V-обла-сти и 300 в С-области), а каждая легкая цепь состоит примерно из 200 аминокислот (100 в V-области и 100 в С-области). Так как каждая аминокислота определяется кодоном из трех оснований (приложение), в последовательности ДНК, необходимой для кодирования каждого HL-гетеродимера, должно быть по крайней мере 1800 (600 • 3) оснований при условии, что и Н-, и L-це-пи кодируются традиционными генами. Если существует 1 млн. разнообразных антител (по современным представлениям эта оценка разумна), это означает, что в геноме человека почти 2 млрд. (1800 • 1 000 000 или 1,8 • 109) оснований кодируют только возможный репертуар антител. Даже если ограничиться только существенной информацией, то есть V-областями, а именно они составляют антигенсвязывающий центр, то это число уменьшится до 0,6 • 109 оснований. А весь геном человека содержит максимум 3—4 млрд. оснований! Таким образом, по самым минимальным оценкам, от 1/6 до 1/2 всей ДНК должны кодировать молекулы антител!
Когда 30 лет назад впервые оценили это число, исследователи поняли, что Ig-гены, кодирующие антитела, должны иметь особую стратегию хранения информации, отличную от других генов. Эти другие гены мы будем называть «однокопийными», или просто генами «домашнего хозяйства». Кроме того, в других работах, проведенных в 1970-е годы, было показано, что в промежутках между генами расположены некодирующие последовательности ДНК, (их часто называют «избыточной» ДНК). Было показано, что на «избыточную» ДНК приходится примерно 98 процентов или даже больше от всей ДНК генома позвоночных. («Избыточная» ДНК не кодирует белковые последовательности, но, по-видимому, играет какую-либо важную функциональную роль. Она может участвовать в упаковке хромосом или в регуляции активности генов и репликации ДНК.) Эти вычисления означали, что если антитела кодируются традиционными генами, то в зародышевой линии хватит кодирующей ДНК только для 10 000 антител, а не для 1 млн., как был оценен репертуар антител. А что же остается для всех генов «домашнего хозяйства?»
Итак, уже к концу 1960-х годов стало очевидно, что все разнообразие антител не может быть закодировано только в половых клетках. Жизнь нуждается в гораздо большем, чем только в производстве антител! Одним из возможных решений явилось предположение, что разнообразие Ig-генов, ответственных за кодирование антител, каким-то образом генерируется соматическими событиями. Работа Сусуми Тонегава, продемонстрировавшая уникальные перестройки ДНК, кодирующей V-области антител, и работы многих других исследователей, показавшие соматическое мутирование V-генов, наконец, разрешили эту проблему. Обсуждение этого вопроса мы продолжим в разделе, посвященном структуре Ig-генов.
| <<< Назад Эволюция иммунной системы |
Вперед >>> Что происходит при заражении? |
- ЛЕКЦИЯ № 2. Морфология и ультраструктура бактерий
- 1. Структура иммуноглобулинов
- ЛЕКЦИЯ № 12. Антитела
- Молекулярная структура антител
- 22. Антитела. Классификации и свойства инов
- 8.3.2. Возрастная структура популяций
- 7.2. Структура биоценоза
- 8.4. Этологическая структура популяций животных
- Об антигенах и антителах
- 8.3. Биологическая структура популяций
- 8.2. Популяционная структура вида
- 1. Структура
