Книга: Самая главная молекула. От структуры ДНК к биомедицине XXI века
Приобретенный иммунитет у бактерий
| <<< Назад Генные глушители |
Вперед >>> 7 Кольцевые ДНК |
Приобретенный иммунитет у бактерий
Не успели улечься страсти вокруг открытия системы РНК-интерференции у растений и животных, как в 2013 году грянула новая технологическая революция, по своим масштабам превзошедшая все предыдущие прорывы за всю историю молекулярной биологии, начиная с ее возникновения в 1953 году. Об этой революционной технологии редактирования генома мы поговорим позже, в главе 10, а сейчас речь пойдет о чисто научном открытии, приведшем к технологическому прорыву, – об открытии приобретенного иммунитета у бактерий.
Вообще, никакого приобретенного иммунитета бактериям иметь категорически не положено. Ведь отдельная бактериальная клетка – это организм, который производит потомство путем простого деления. Если при соприкосновении с конкретным вирусом (вирусы бактерий называются бактериофагами, или просто «фагами») бактерия приобретает иммунитет против заражения этим вирусом, то она передаст этот признак своим потомкам. Но тогда чем способность бактерий передавать приобретенный признак отличается от того, что собака, у которой отрубили хвост, передаст этот признак (иметь короткий хвост) своим потомкам? Послушайте, да это же подлинный ламаркизм или, хуже того, лысенковщина! Это есть не что иное, как наследование благоприобретенных признаков! Утверждать такое – это анафема. Ведь именно то, что благоприобретенные признаки не могут наследоваться, имел в виду великий русский генетик Николай Иванович Вавилов, когда говорил свои знаменитые слова: «На костер пойдем, гореть будем, но от убеждений своих не откажемся». И пошел на костер, и сгорел (точнее, был уморен голодом в заточении).
Интересно, что последний гвоздь в гроб ламаркизма и лысенковщины был забит именно в опытах с бактериями и их вирусами. Эти опыты были проведены в США Сальвадором Лурией и Максом Дельбрюком (тем самым, берлинским учеником Тимофеева-Ресовского и основателем фаговой группы в США, о котором мы уже говорили в главе 1) в 1943 году, и главным образом за эти опыты Лурия и Дельбрюк были удостоены Нобелевской премии по физиологии и медицине за 1969 год. В чем же состояли эти знаменитые опыты, которые, как считалось до самого недавнего времени, раз и навсегда поставили крест на концепции наследования благоприобретенных признаков?
Лурии и Дельбрюку было прекрасно известно, что, если на чашку Петри содержащую и питательный агар, и фаг, убивающий данный штамм, высеять бактерии, подавляющее количество из них погибнет, но отдельные клетки выживут. И исследователи задались вопросом: эти устойчивые клетки есть мутанты, уже присутствовавшие среди нормальных клеток до их соприкосновения с фагом, или малая доля клеток приобрела иммунитет против фага в момент контакта с ним? Иными словами, является устойчивость к фаговой инфекции результатом случайной мутации или это благоприобретенный признак? Чтобы различить эти две возможности, опыт был поставлен следующим образом.
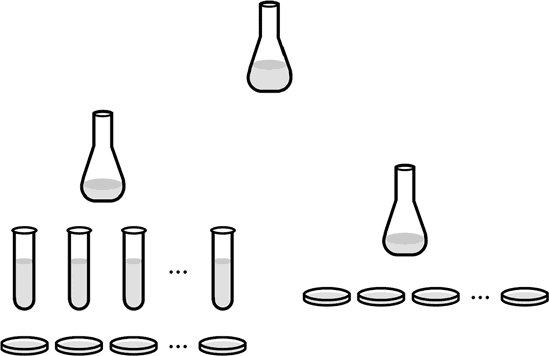
Рис. 23. Схема опыта Лурии-Дельбрюка
Выращенные в питательном бульоне клетки были тщательно перемешаны и разделены на две равные части. Из одной половины клеток, показанной на рис. 23 справа, были при помощи пипетки сразу же взяты пробы определенного объема и высеяны на чашки Петри с агаром и фагом. Вторая половина, та, что слева, была сначала разлита в то же число пробирок, сколько чашек Петри справа, проинкубирована достаточное время, чтобы клетки могли размножиться, и только потом из каждой пробирки, после тщательного перемешивания, была взята своя проба того же объема, что и в случае справа, и высеяна на свою чашку Петри (рис. 23). Затем, дав выжившим клеткам время размножиться, образовавшиеся колонии были посчитаны во всех чашках Петри. Какой результат следовало ожидать в случае мутационной гипотезы, а какой – в случае гипотезы приобретенного иммунитета, т. е. наследования благоприобретенных признаков?
Ясно, что в случае приобретенного иммунитета результат опыта в обоих случаях (левая и правая сторона рис. 23) должен быть один и тот же, ведь иммунитет приобретается в момент контакта между бактерией и фагом, так что манипуляции с клетками до такого контакта значения не имеют.
Так что в случае иммунитета Лурия и Дельбрюк должны были наблюдать примерно одинаковое число колоний в чашках Петри, как в левом случае, так и в правом. Конечно, поскольку иммунитет приобретается случайно, малой частью бактерий, количество колоний в разных чашках должно немного флуктуировать, подчиняясь так называемому пуассоновскому распределению. Если же верна мутационная гипотеза, то пуассоновское распределение должно наблюдаться только для постановки опыта, как в правой части рис. 23; для постановки опыта согласно схеме слева распределение не должно быть пуассоновским. Пуассоновским должно быть в этом случае распределение мутантов по пробиркам. После наращивания бактерий в пробирках и высевания их на чашки Петри распределение колоний должно быть гораздо более широким, чем пуассоновское. В самом деле, можно ожидать, что в каких-то чашках вообще не окажется колоний, но практически не должно быть чашек с одной или несколькими колониями, так как, даже если в пробирке оказалась только одна мутантная клетка, она многократно размножилась за время инкубации и высевание даст множество колоний.
Проверить, является ли распределение пуассоновским, очень просто. Если через m1 m2 … m10 обозначить число колоний в соответствующей чашке Петри (предположим, что их 10), то для пуассоновского распределения должно выполняться равенство:
(m1+ m2 +…m10) / 10 = (m12 + m22 +…m102) / /10 – (m1 + m2 +…m10)2 / 100
Иными словами, для пуассоновского распределения среднее значение (левая часть равенства) должно совпадать с дисперсией (правая часть).
Теперь давайте посмотрим, что же Лурия и Дельбрюк наблюдали экспериментально в своей работе 1943 года. В случае левой части на рис. 23 значения m были следующими:
14, 15, 13, 21, 15, 14, 26, 16, 20, 13.
Подставив эти значения в левую часть равенства, получим 16,7, подставив в правую, получим 16,4. Вывод ясен: Пуассон. Теперь посмотрим, что получилось в случае опыта, поставленного по схеме слева на рис. 23:
107, 0, 0, 0, 1, 0, 0, 64, 0, 35.
Среднее (левая часть равенства) не сильно отличается от предыдущего случая, оно получается 20,7, но дисперсия (правая часть равенства): 1268,7! Ничего похожего на пуассоновское распределение.
Своим, ставшим классическим, опытом, повторенным разными исследователями на разных парах бактерия-фаг тысячи раз, Лурия и Дельбрюк вбили последний гвоздь в гроб концепции наследования благоприобретенных признаков, в котором (гробу) она (эта концепция, известная также как ламаркизм) пролежала 60 лет, а потом взяла да воскресла. Потому что оказалось, что у бактерий есть система приобретенного иммунитета, специально направленная на защиту от бактериофагов и плазмид, т. е. от вторжения в бактериальную клетку чужой ДНК. Как же такое могло случиться? Неужели в опыте Лурии и Дельбрюка обнаружился какой-то изъян?
Нет, с опытом Лурии и Дельбрюка все в порядке, и в таких опытах действительно наблюдается спонтанное возникновение мутантов, устойчивых к фагу, и ни в одном из тысяч экспериментов такого рода не наблюдалось явление приобретенного иммунитета. Просто принцип или—или (или мутация – или иммунитет) не работает в биологии именно потому, что живая природа – это продукт эволюции в течение невообразимо длинного отрезка времени в 3,5 миллиарда лет. В биологии почти всегда оказывается, что справедлив принцип и—и, т. е. в нашем случае и мутации – и иммунитет. Иными словами, в науке о живой природе нет правил без исключений, нет строгих и незыблемых законов, как в физике, науке о неживой природе. У биологов не должно быть убеждений, за которые они были бы готовы пойти на костер: сгорят все, некому будет работать.
Мне известен только один закон живой природы, который не имеет исключений: у всех живых организмов генетическая информация содержится в форме двойной спирали ДНК. (Вирусы не в счет: они не способны к автономному существованию, помимо живой клетки.) То, что этот закон не знает исключений, означает, что жизнь на планете Земля возникла только один раз и все живые существа произошли от этой клетки-прародительницы. Но я не готов пойти на костер за это свое убеждение, потому что нет никакого запрета с точки зрения незыблемых законов физики, чтобы «самой главной молекулой» была не ДНК, а, скажем, РНК, что, по-видимому, и имело место на самых ранних этапах возникновения жизни, в эпоху РНКового мира. Более того, у меня нет сомнений, что рано или поздно человеку удастся создать полностью искусственную жизнь и в этих искусственных клетках носителем генетической информации будет не ДНК, а нечто другое, может быть, та же РНК.
Почему же опыт Лурии и Дельбрюка был воспринят не тем, чем он был: свидетельством важной роли случайных мутаций у бактерий в приобретении устойчивости к заражению фагами? Почему этот опыт был воспринят генетическим сообществом гораздо шире: как окончательное доказательство того, что наследование благоприобретенных признаков невозможно – нигде и никогда?
Скорее всего, здесь сыграли роль не столько научные, сколько политические мотивы. Мировое генетическое сообщество с ужасом наблюдало в течение ряда лет, как русская генетическая школа, едва ли не самая сильная в мире, систематически истреблялась самыми жестокими методами сталинским режимом, который поднял на щит шарлатана Трофима Лысенко, исповедовавшего ламаркизм в его самой вульгарной форме. Особенно остро генетическое сообщество восприняло исчезновение одного из самых уважаемых своих членов – Николая Вавилова, даже еще не зная о его ужасной участи. Конечно, масло в огонь подлила печально знаменитая сессия ВАСХНИЛ 1948 года, где генетика подверглась полному разгрому. А затем еще началась открыто антисемитская кампания «борьбы с космополитизмом». Насколько генетики всего мира были вовлечены в эти события, можно судить по тому, что, когда в 1949 году в журнале «Огонек» была опубликована чудовищная статья под названием «Мухолюбы-человеконенавистники», обвинившая генетику и генетиков во всех смертных грехах, английский перевод этой статьи был сразу же опубликован в ведущем международном научном журнале по генетике Journal of Heredity. Так что неудивительно, что в 1940-е годы и позднее ламаркизм стал вызывать у генетиков всего цивилизованного мира самые ужасные ассоциации. Не могло быть более страшного оскорбления в адрес биолога, чем назвать его ламаркистом или, боже упаси, лысенковцем.
Но вернемся к приобретенному иммунитету у бактерий. Как же его удалось обнаружить? Это открытие – прямое следствие успехов в области секвенирования геномов. Первые 10 лет после того, как Фредерик Сенгер изобрел свой метод секвенирования ДНК, дело продвигалось очень медленно. Как уже отмечалось в главе 5, всерьез эра секвенирования геномов началась после изобретения метода ПЦР в середине 1980-х годов, позволившего получать неограниченное количество копий выбранного исследователем участка ДНК (см. главу 10), и после широкого развития Интернета. К концу 1980-х годов даже геном кишечной палочки не был еще расшифрован и исследователи секвенировали отдельные участки этого генома. В 1987–1989 годах группа японских ученых из университета Осаки во главе с Атсуо Наката сообщила в специализированном микробиологическом журнале об обнаружении очень странного участка в геноме кишечной палочки. Он состоял из повторяющейся 14 раз идентичной последовательности из 29 нуклеотидов, причем эти повторы были отделены друг от друга промежуточными последовательностями из 32–33 нуклеотидов, не имеющими между собой ничего общего (рис. 24). Авторы не высказали никакой гипотезы, что бы это могло значить, и их статьи не привлекли ничьего внимания.
Спустя более 10 лет этими странными повторами заинтересовался испанский микробиолог Франциско Мохика. К началу 2000-х годов геномная база данных пополнилась множеством геномов бактерий и их вирусов. Мохика с соавторами обнаружил, что очень у многих бактерий наблюдаются участки, похожие на те, что были впервые описаны Накатой. Они получили длинное и неуклюжее название, которое сокращается как КРИСПР. Но самое главное, Мохика сравнил последовательности неповторяющихся промежутков между повторами с последовательностью различных вирусов и плазмид и обнаружил, что часто последовательности промежутков заимствованы из последовательностей ДНК фагов или плазмид, как раз тех, которые паразитируют на данной бактерии. При этом фаги, чьи участки перенесены в виде промежутков в кассету КРИСПР, не могут заражать бактерию. В своей статье 2005 года Мохика впервые предположил, что кассеты КРИСПР как-то связаны с иммунитетом у бактерий против чужой ДНК.

Рис. 24. Повторы, обнаруженные Атсуо Накатой с сотрудниками в геноме кишечной палочки. Ясно видно, что последовательность из 29 нуклеотидов (подчеркнуто) строго повторяется 14 раз, в то время как между промежуточными последовательностями, содержащими от 32 до 33 нуклеотидов, нет ничего общего
Это было поворотным моментом. К изучению системы КРИСПР подключился крупнейший американский биоинформатик российского происхождения Евгений Кунин, который углубил и расширил анализ последовательностей. Были выявлены кодирующие белки гены, участвующие в КРИСПР, получившие название «кас». Большой вклад в изучение проблемы внес российско-американский микробиолог Константин Северинов. Затем подоспели молекулярные биологи, которые довольно быстро разобрались в деталях того, как осуществляется иммунная реакция.
А происходит следующее (рис. 25). Вся кассета КРИСПР транскрибируется. Получившаяся РНК нарезается на куски, каждый из которых содержит один повтор и один промежуток. Такая небольшая молекула РНК, содержащая около 60 нуклеотидов, обозначается как крРНК. Ген кас экспрессирует кас-белок, который связывается с крРНК и начинает внимательно обследовать двунитевую ДНК в клетке. Белок локально раскрывает двойную спираль и примеряет к раскрытому участку крРНК. Когда происходит комплементарная гибридизация между крРНК и одной из цепей ДНК, кас-белок режет обе цепи ДНК, создавая двунитевой разрыв двойной спирали. Такой разрыв ведет к деградации ДНК в бактериальной клетке. Вторгшаяся в клетку плазмидная или фаговая ДНК обезврежена.
Почему же комплекс крРНК с кас-белком не набрасывается на саму кассету КРИСПР и не производит разрыв геномной ДНК бактерии? Для этого существует специальная, очень короткая последовательность, которая присутствует в ДНК фага или плазмиды и узнается кас-белком, но которая отсутствует в кассете КРИСПР. В отсутствие этой последовательности кас-белок не работает.
Таким оказался механизм приобретенного иммунного ответа бактерий. Да, остается только признать: в эклектическом буйстве жизни, с которым нам приходится иметь дело, нашлось место и Ламарку. Но громадный интерес, который привлекает к себе обнаруженный у бактерий иммунитет, связан не с частичной реабилитацией ламаркизма, а с практическими приложениями системы КРИСПР-кас в области редактирования генома в живой эукариотической клетке, о чем речь пойдет в главе 11.
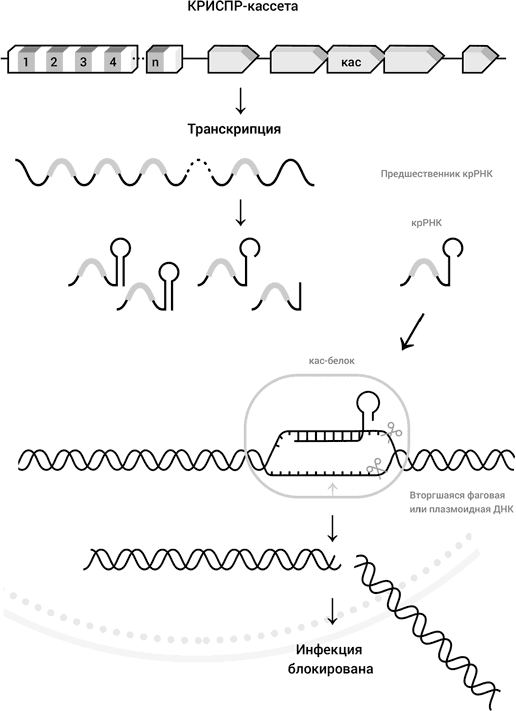
Рис. 25. Механизм приобретенного иммунитета у бактерий (КРИСПР). КРИСПР-кассета состоит из повторов (белые участки) и промежутков 1, 2, 3,4… n. В случае кишечной палочки n = 13 (см. рис. 24). За КРИСПР-кассетой следуют гены, кодирующие кас-белки. Вся кассета транскрибируется и затем нарезается на отдельные крРНК, каждая из которых несет только одну промежуточную последовательность. Кас-белок связывает одну из крРНК, локально раскрывает двойную спираль вторгшейся ДНК, и когда происходит гибридизация между крРНК и участком вторгшейся ДНК, кас-белок наносит два однонитевых разрыва в обеих цепях раскрытой области двойной спирали: инфекция блокирована
| <<< Назад Генные глушители |
Вперед >>> 7 Кольцевые ДНК |
- Глава 29 Приобретенный иммунитет. Антигены
- 4. Морфология бактерий, основные органы
- Микробы хорошие и плохие. Наше здоровье и выживание в мире бактерий.
- 7. Виды метаболизма бактерий
- ЛЕКЦИЯ № 2. Морфология и ультраструктура бактерий
- ЛЕКЦИЯ № 3. Физиология бактерий
- 5. Морфология бактерий, дополнительные органеллы
- Бактериофаги, или «пожиратели бактерий»
- 2. Изменчивость у бактерий
- 2. Питание бактерий
- Врожденный иммунитет
- 4. Особенности противовирусного иммунитета
