Книга: Медицинская микробиология, иммунология и вирусология
Микробиология дифтерии
| <<< Назад Глава 62 Возбудители капельных инфекций |
Вперед >>> Микробиология коклюша и паракоклюша |
Микробиология дифтерии
Дифтерия – острое инфекционное заболевание преимущественно детского возраста, которое проявляется глубокой интоксикацией организма дифтерийным токсином и характерным фибринозным воспалением в месте локализации возбудителя. Название болезни происходит от греческого слова diphthera – кожа, пленка, так как в месте размножения возбудителя образуется плотная, серовато-белого цвета пленка.
Возбудитель дифтерии – Corynebacterium diphtheriae – был обнаружен впервые в 1883 г. Э. Клебсом в срезах из пленки, получен в чистой культуре в 1884 г. Ф. Леффлером. В 1888 г. Э. Ру и А. Иерсен обнаружили его способность продуцировать экзотоксин, играющий главную роль в этиологии и патогенезе дифтерии. Получение в 1892 г. антитоксической сыворотки Э. Берингом и использование ее с 1894 г. для лечения дифтерии позволило значительно снизить летальность. Успешное наступление на эту болезнь началось после 1923 г. в связи с разработкой Г. Рамоном метода получения дифтерийного анатоксина.
Возбудитель дифтерии относится к роду Corynebacterium (класс Actinobacteria). В морфологическом отношении характеризуется тем, что клетки булавовидно утолщены на концах (греч. coryne – булава), образуют ветвление, особенно в старых культурах, и содержат зернистые включения.
Установлена этиологическая роль коринебактерий, не относящихся к коринебактерии дифтерии, так называемых Corynebacterium non diphtheriae, которые способны вызывать не только заболевания верхних дыхательных путей, но и отиты, эндокардиты, бронхиты, пневмонии, уретриты, пиелонефриты и др. Возбудителями таких заболеваний чаще всего бывают Corynebacterium pseudodiphtheriticum, C. xerosis, C. pseudotuberculosis и C. urealyticum.
C. diphtheriae – прямые или слегка изогнутые неподвижные палочки длиной 1,0 – 8,0 мкм и диаметром 0,3 – 0,8 мкм, спор и капсул не образуют. Очень часто они имеют вздутия на одном или обоих концах, часто содержат метахроматические гранулы – зерна волютина (полиметафосфаты), которые при окрашивании метиленовым синим приобретают голубовато-пурпурный цвет. Для их обнаружения предложен особый метод окрашивания по Нейссеру. При этом палочки окрашиваются в соломенно-желтый, а зерна волютина – в темно-коричневый цвет, и располагаются обычно по полюсам (см. цв. вкл., рис. 102.2 и 3). C. diphtheriae хорошо окрашивается анилиновыми красителями, грамположительна, но в старых культурах нередко обесцвечивается и имеет отрицательную окраску по Граму. Для нее характерен выраженный полиморфизм, особенно в старых культурах и под влиянием антибиотиков (см. рис. 102.1). Содержание Г + Ц в ДНК около 60 мол %.
Дифтерийная палочка является аэробом или факультативным анаэробом, температурный оптимум для роста 35 – 37 °C (границы роста 15 – 40 °C), оптимальная рН 7,6 – 7,8. К питательным средам не очень требовательна, но лучше растет на средах, содержащих сыворотку или кровь. Избирательными для дифтерийных бактерий являются свернутые сывороточные среды Ру или Леффлера, рост на них появляется через 8 – 12 ч в виде выпуклых, величиной с булавочную головку колоний серовато-белого или желтовато-кремового цвета. Поверхность их гладкая или слегка зернистая, на периферии колонии несколько более прозрачные, чем в центре. Колонии не сливаются, вследствие чего культура приобретает вид шагреневой кожи. На бульоне рост проявляется в виде равномерного помутнения, либо бульон остается прозрачным, а на его поверхности образуется нежная пленка, которая постепенно утолщается, крошится и хлопьями оседает на дно.
Особенностью дифтерийных бактерий является их хороший рост на кровяных и сывороточных средах, содержащих такие концентрации теллурита калия, которые подавляют рост других видов бактерий. Это связано с тем, что C. diphtheriae восстанавливают теллурит калия до металлического теллура, который, откладываясь в микробных клетках, придает колониям характерный темно-серый или черный цвет. Применение таких сред повышает процент высеваемости дифтерийных бактерий (рис. 103).
C. diphtheriae ферментируют глюкозу, мальтозу, галактозу с образованием кислоты без газа, но не ферментируют (как правило) сахарозу, имеют цистиназу, не имеют уреазы и не образуют индола. По этим признакам они отличаются от тех коринеформных бактерий (дифтероидов), которые чаще других встречаются на слизистой оболочке глаза (C. xerosus) и носоглотки (C. pseudodiphtheriticum) и от других дифтероидов (табл. 44).
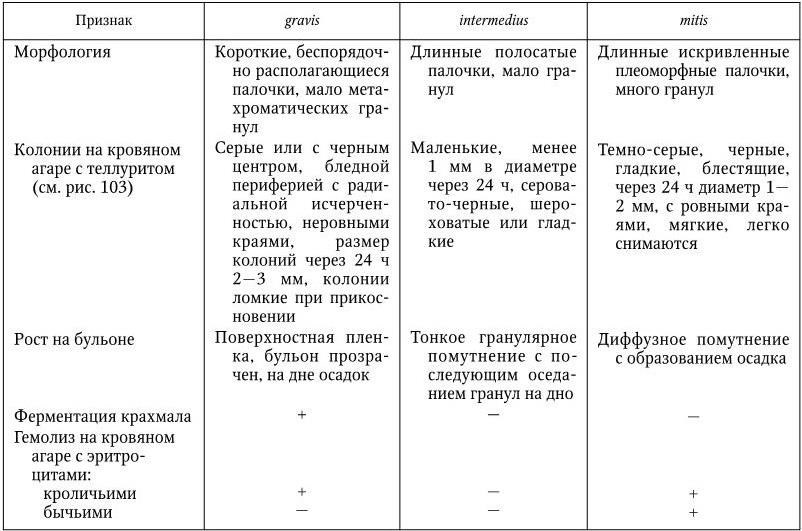
В природе существуют три основных варианта (биотипа) дифтерийной палочки: gravis, intermedius и mitis. Они различаются по морфологическим, культуральным, биохимическим и другим свойствам (табл. 45).
Деление дифтерийных бактерий на биотипы было произведено с учетом того, при каких формах течения дифтерии у больных они выделяются с наибольшей частотой. Тип gravis чаще выделяется от больных с тяжелой формой дифтерии и вызывает групповые вспышки. Тип mitis вызывает более легкие и спорадические случаи заболеваний, а тип intermedius занимает промежуточное положение между ними. C. belfanti, ранее относимый к биотипу mitis, выделен в самостоятельный, четвертый, биотип. Его главное отличие от биотипов gravis и mitis – способность восстанавливать нитраты в нитриты. Штаммы C. belfanti обладают выраженными адгезивными свойствами, и среди них обнаруживаются как токсигенные, так и нетоксигенные варианты.
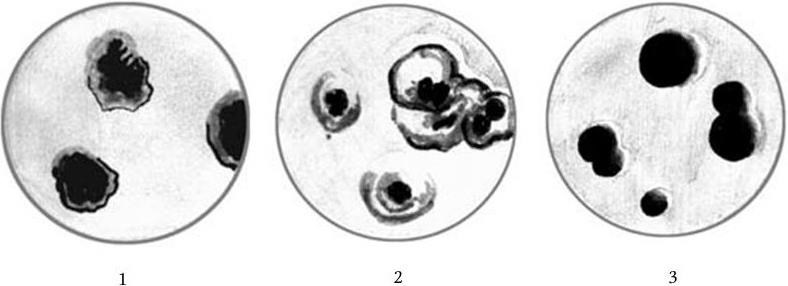
Рис. 103. Рост биотипов Corynebacterium diphtheriae на среде с теллуритом:
1 – gravis; 2 – intermedius; 3 – mitis
Таблица 44
Дифференциальные признаки, отличающие C. diphtheriae от некоторых дифтероидов
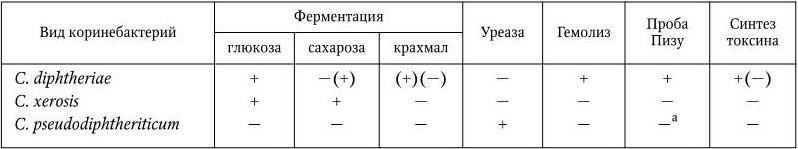
Примечание.(+) – признак положительный; ( – ) – признак отрицательный; (+)( – ) – признак иногда положительный, иногда отрицательный; а – проба Пизу выявляет наличие цистиназы.
Таблица 45
Дифференциальные признаки биотипов gravis, intermedius и mitis
Антигенная структура коринебактерий очень гетерогенна и мозаична. У возбудителей дифтерии всех трех типов обнаружено несколько десятков соматических антигенов, по которым их делят на серотипы. В России принята серологическая классификация, по которой различают 11 серотипов дифтерийных бактерий, из них 7 основных (1 – 7) и 4 дополнительных, редко встречающихся серотипов (8 – 11). Шесть серотипов (1, 2, 3, 4, 5, 7) относятся к типу gravis, а пять (6, 8, 9, 10, 11) – к типу mitis. Недостатком метода серотипирования является то, что многие штаммы, особенно нетоксигенные, обладают спонтанной агглютинацией или полиагглютинабельностью.
Фаготипирование C. diphtheriae. Для дифференциации дифтерийных бактерий предложены различные схемы фаготипирования. По схеме М. Д. Крыловой с помощью набора из 9 фагов (A, B, C, D, F, G, H, I, K) удается типировать большинство токсигенных и нетоксигенных штаммов типа gravis. С учетом чувствительности к указанным фагам, а также культуральных, антигенных свойств и способности синтезировать корицины (бактерицидные белки) М. Д. Крылова выделила 3 самостоятельные группы коринебактерий типа gravis (I – III). В каждой из них имеются подгруппы токсигенных и их нетоксигенных аналогов возбудителей дифтерии.
Резистентность возбудителей дифтерии. C. diphtheriae проявляет большую устойчивость к низким температурам, но быстро погибает при высокой температуре: при 60 °C – в течение 15 – 20 мин, при кипячении – через 2 – 3 мин. Все дезинфицирующие вещества (лизол, фенол, хлорамин и др.) в обычно применяемой концентрации уничтожают ее за 5 – 10 мин. Однако возбудитель дифтерии хорошо переносит высушивание и может долго сохранять жизнеспособность в высохшей слизи, слюне, в частичках пыли. В мелкодисперсном аэрозоле дифтерийные бактерии сохраняют жизнеспособность в течение 24 – 48 ч.
Факторы патогенности. Патогенность C. diphtheriae определяется наличием ряда факторов:
1. Факторов адгезии, колонизации и инвазии. Структуры, ответственные за адгезию, не идентифицированы, однако без них дифтерийная палочка не смогла бы колонизировать клетки. Их роль выполняют какие-то компоненты клеточной стенки возбудителя. Инвазивные свойства возбудителя связаны с гиалуронидазой, нейраминидазой и протеазой.
2. Токсического гликолипида, содержащегося в клеточной стенке возбудителя. Он представляет собой 6,6'-диэфир трегалозы, содержащий коринемиколовую кислоту (С32Н64О3) и коринемиколиновую кислоту (С32Н62О3) в эквимолярных отношениях (трегалозо-6,6'-дикоринемиколат). Гликолипид оказывает разрушающее действие на клетки ткани в месте размножения возбудителя.
3. Экзотоксина, обусловливающего патогенность возбудителя и характер патогенеза заболевания. Нетоксигенные варианты C. diphtheriae дифтерии не вызывают.
Экзотоксин синтезируется в виде неактивного предшественника – единой полипептидной цепи с м. м. 61 кД. Его активация осуществляется собственной бактериальной протеазой, которая разрезает полипептид на два связанные между собой дисульфидными связями пептида: А (м. м. 21 кД) и В (м. м. 39 кД). Пептид В выполняет акцепторную функцию – он распознает рецептор, связывается с ним и формирует внутримембранный канал, через который проникает в клетку пептид А и реализует биологическую активность токсина. Пептид А представляет собой фермент АДФрибозилтрансферазу, который обеспечивает перенос аденозиндифосфатрибозы из НАД на один из аминокислотных остатков (гистидина) белкового фактора элонгации EF-2. В результате модификации EF-2 утрачивает свою активность, и это приводит к подавлению синтеза белка рибосомами на стадии транслокации. Токсин синтезируют только такие C. diphtheriae, которые несут в своей хромосоме гены умеренного конвертирующего профага. Оперон, кодирующий синтез токсина, является моноцистронным, он состоит из 1,9 тыс. пар нуклеотидов и имеет промотор toxP и 3 участка: toxS, toxA и toxB. Участок toxS кодирует 25 аминокислотных остатков сигнального пептида (он обеспечивает выход токсина через мембрану в периплазматическое пространство бактериальной клетки), toxA – 193 аминокислотных остатка пептида А, и toxB – 342 аминокислотных остатка пептида В токсина. Утрата клеткой профага или мутации в tox-опероне делают клетку малотоксигенной. Напротив, лизогенизация нетоксигенных C. diphtheriae конвертирующим фагом превращает их в токсигенные бактерии. Это доказано однозначно: токсигенность дифтерийных бактерий зависит от лизогенизации их конвертирующими tox-коринефагами. Коринефаги интегрируются в хромосому коринебактерий с помощью механизма сайт-специфической рекомбинации, причем штаммы дифтерийных бактерий могут содержать в своих хромосомах по 2 сайта рекомбинации (attB), и коринефаги интегрируются в каждый из них с одинаковой частотой.
Генетический анализ ряда нетоксигенных штаммов дифтерийных бактерий, проведенный с помощью меченых ДНК-зондов, несущих фрагменты tox-оперона коринефага, показал, что в их хромосомах имеются последовательности ДНК, гомологичные tox-оперону коринефага, но они либо кодируют неактивные полипептиды, либо находятся в «молчащем» состоянии, т. е. неактивны. В связи с этим возникает очень важный в эпидемиологическом отношении вопрос: могут ли нетоксигенные дифтерийные бактерии превращаться в токсигенные в естественных условиях (в организме человека), подобно тому, как это происходит in vitro? Возможность подобного превращения нетоксигенных культур коринебактерий в токсигенные с помощью фаговой конверсии была показана в опытах на морских свинках, куриных эмбрионах и белых мышах. Однако происходит ли это в ходе естественного эпидемического процесса (и если происходит, то как часто), пока установить не удалось.
В связи с тем, что дифтерийный токсин в организме больных оказывает избирательное и специфическое воздействие на определенные системы (поражаются в основном симпатико-адреналовая система, сердце, сосуды и периферические нервы), то очевидно, он не только угнетает биосинтез белка в клетках, но и вызывает другие нарушения их метаболизма.
Для обнаружения токсигенности дифтерийных бактерий можно использовать следующие способы:
1. Биологические пробы на животных. Внутрикожное заражение морских свинок фильтратом бульонной культуры дифтерийных бактерий вызывает у них некроз в месте введения. Одна минимальная смертельная доза токсина (20 – 30 нг) убивает морскую свинку весом 250 г при подкожном введении на 4 – 5-й день. Наиболее характерным проявлением действия токсина является поражение надпочечников, они увеличены и резко гиперемированы (см. цв. вкл., рис. 102.4).
2. Заражение куриных эмбрионов. Дифтерийный токсин вызывает их гибель.
3. Заражение культур клеток. Дифтерийный токсин вызывает отчетливый цитопатический эффект.
4. Метод твердофазного иммуноферментного анализа с использованием меченных пероксидазой антитоксинов.
5. Использование ДНК-зонда для непосредственного обнаружения tox-оперона в хромосоме дифтерийных бактерий.
Однако наиболее простым и распространенным способом определения токсигенности дифтерийных бактерий является серологический – метод преципитации в геле. Суть его состоит в следующем. Полоску стерильной фильтровальной бумаги размером 1,5 ? 8 см смачивают антитоксической противодифтерийной сывороткой, содержащей 500 АЕ в 1 мл, и наносят на поверхность питательной среды в чашке Петри. Чашку подсушивают в термостате 15 – 20 мин. Исследуемые культуры засевают бляшками по обе стороны от бумажки. На одну чашку засевают несколько штаммов, один из которых, заведомо токсигенный, служит контролем. Чашки с посевами инкубируют при 37 °C, результаты учитывают через 24 – 48 ч. Вследствие встречной диффузии в геле антитоксина и токсина в месте их взаимодействия образуется четкая линия преципитации, которая сливается с линией преципитации контрольного токсигенного штамма (см. рис. 73, с. 288). Полоски неспецифической преципитации (они образуются, если в сыворотке кроме антитоксина присутствуют в небольшом количестве другие антимикробные антитела) появляются поздно, выражены слабо и никогда не сливаются с полоской преципитации контрольного штамма.
Эпидемиология. Единственным источником заражения является человек – больной, выздоравливающий или здоровый бактерионоситель. Заражение происходит воздушно-капельным, воздушно-пылевым путем, а также через различные предметы, бывшие в употреблении у больных или здоровых бактерионосителей: посуда, книги, белье, игрушки и т. п. В случае инфицирования пищевых продуктов (молоко, кремы и т. п.) возможно заражение алиментарным путем. Наиболее массивное выделение возбудителя имеет место при острой форме заболевания. Однако наибольшее эпидемиологическое значение имеют лица со стертыми, нетипичными формами заболевания, так как они часто не госпитализируются и выявляются далеко не сразу. Больной дифтерией заразен в течение всего периода болезни и части периода выздоровления. Средний срок бактерионосительства у выздоравливающих варьирует от 2 до 7 нед., но может продолжаться и до 3 мес.
Особую роль в эпидемиологии дифтерии играют здоровые бактерионосители. В условиях спорадической заболеваемости именно они являются основными распространителями дифтерии, способствуя и сохранению возбудителя в природе. Средняя продолжительность носительства токсигенных штаммов несколько меньше (около 2 мес.), чем нетоксигенных (около 2 – 3 мес.).
Причина формирования здорового носительства токсигенных и нетоксигенных дифтерийных бактерий раскрыта не до конца, так как даже высокий уровень антитоксического иммунитета не всегда обеспечивает полное освобождение организма от возбудителя. Возможно, определенное значение имеет уровень антибактериального иммунитета. Первостепенное эпидемиологическое значение имеет носительство токсигенных штаммов дифтерийных бактерий.
Особенности патогенеза и клиники. К дифтерии восприимчивы люди любого возраста. Возбудитель может проникнуть в организм человека через слизистые оболочки различных органов или через поврежденную кожу. В зависимости от локализации процесса различают дифтерию зева, носа, гортани, уха, глаза, половых органов и кожи. Возможны смешанные формы, например дифтерия зева и кожи и т. п. Инкубационный период – 2 – 10 дней. При клинически выраженной форме дифтерии в месте локализации возбудителя развивается характерное фибринозное воспаление слизистой оболочки. Токсин, вырабатываемый возбудителем, сначала поражает эпителиальные клетки, а затем близлежащие кровеносные сосуды, повышая их проницаемость. В выходящем экссудате содержится фибриноген, свертывание которого приводит к образованию на поверхности слизистой оболочки серовато-белого цвета пленчатых налетов, которые плотно спаяны с подлежащей тканью и при отрыве от нее вызывают кровотечение. Следствием поражения кровеносных сосудов может быть развитие местного отека. Особенно опасной является дифтерия зева, так как она может стать причиной дифтерийного крупа вследствие отека слизистой оболочки гортани и голосовых связок, от которого раньше погибало в результате асфиксии 50 – 60 % больных дифтерией детей. Дифтерийный токсин, поступая в кровь, вызывает общую глубокую интоксикацию. Он поражает преимущественно сердечно-сосудистую, симпатико-адреналовую системы и периферические нервы. Таким образом, клиника дифтерии складывается из сочетания местных симптомов, зависящих от локализации входных ворот, и общих симптомов, обусловленных отравлением токсином и проявляющихся в виде адинамии, вялости, бледности кожных покровов, понижения кровяного давления, миокардита, паралича периферических нервов и других нарушений. Дифтерия у привитых детей, если и наблюдается, протекает, как правило, в легкой форме и без осложнений. Летальность в период до применения серотерапии и антибиотиков составляла 50 – 60 %, ныне – 3 – 6 %.
Постинфекционный иммунитет прочный, стойкий, фактически пожизненный, повторные случаи заболевания наблюдаются редко – у 5 – 7 % переболевших. Иммунитет носит главным образом антитоксический характер, меньшее значение имеют антимикробные антитела.
Для оценки уровня противодифтерийного иммунитета ранее широко применялась проба Шика. С этой целью внутрикожно детям вводилась 1/40 Dlm токсина для морской свинки в объеме 0,2 мл. При отсутствии антитоксического иммунитета через 24 – 48 ч на месте введения появляется краснота и припухлость диаметром более 1 см. Такая положительная реакция Шика свидетельствует либо о полном отсутствии антитоксина, либо о том, что его содержание составляет менее 0,001 АЕ/мл крови. Отрицательная реакция Шика наблюдается, когда содержание антитоксина в крови выше 0,03 АЕ/мл. При содержании антитоксина ниже 0,03 АЕ/мл, но выше 0,001 АЕ/мл реакция Шика может быть или положительной, или, иногда, отрицательной. Кроме того, сам токсин обладает выраженным аллергенным свойством. Поэтому для определения уровня противодифтерийного иммунитета (количественное содержание антитоксина) лучше пользоваться РПГА с эритроцитарным диагностикумом, сенсибилизированным дифтерийным анатоксином.
Лабораторная диагностика. Единственным методом микробиологической диагностики дифтерии является бактериологический, с обязательной проверкой выделенной культуры коринебактерий на токсигенность. Бактериологические исследования на дифтерию проводят в трех случаях:
1) для диагностики дифтерии у детей и взрослых с острыми воспалительными процессами в области зева, носа, носоглотки;
2) по эпидемическим показаниям лиц, находившихся в контакте с источником возбудителя дифтерии;
3) лиц, вновь поступающих в детские дома, ясли, школы-интернаты, другие специальные учреждения для детей и взрослых, с целью выявления среди них возможных бактерионосителей дифтерийной палочки.
Материалом для исследования служат слизь из зева и носа, пленка с миндалин или других слизистых оболочек, являющихся местом входных ворот возбудителя. Посевы производят на теллуритовые сывороточные или кровяные среды и одновременно на свернутые сывороточные среды Ру (свернутая лошадиная сыворотка) или Леффлера (3 части бычьей сыворотки + 1 часть сахарного бульона), на которых рост коринебактерий появляется уже через 8 – 12 ч. Выделенную культуру идентифицируют по совокупности морфологических, культуральных и биохимических свойств, по возможности используют методы серо– и фаготипирования. Во всех случаях обязательна проверка на токсигенность одним из указанных выше методов. Морфологические особенности коринебактерий лучше изучать, используя три метода окрашивания препарата-мазка: по Граму, Нейссеру и метиленовым синим (или толуидиновым синим).
Лечение. Специфическим средством лечения дифтерии является применение противодифтерийной антитоксической сыворотки, содержащей не менее 2000 МЕ в 1 мл. Сыворотку вводят внутримышечно в дозах от 10 000 до 400 000 МЕ в зависимости от тяжести течения болезни. Эффективным методом лечения является применение антибиотиков (пенициллины, тетрациклины, эритромицин и др.) и сульфаниламидных препаратов. С целью стимулирования выработки собственных антитоксинов можно использовать анатоксин. Для освобождения от бактерионосительства следует использовать те антибиотики, к которым данный штамм коринебактерий высокочувствителен.
Специфическая профилактика. Основным методом борьбы с дифтерией является массовая плановая вакцинация населения. С этой целью используют различные варианты вакцин, в том числе комбинированные, т. е. направленные на одновременное создание иммунитета против нескольких возбудителей. Наибольшее распространение в России получила вакцина АКДС. Она представляет собой адсорбированную на гидроокиси алюминия взвесь коклюшных бактерий, убитых формалином или мертиолятом (20 млрд в 1 мл), и содержит дифтерийный анатоксин в дозе 30 флоккулирующих единиц и 10 единиц связывания столбнячного анатоксина в 1 мл. Вакцинируют детей с 3-месячного возраста, а затем проводят ревакцинации: первую через 1,5 – 2 года, последующие в возрасте 9 и 16 лет, а далее через каждые 10 лет.
Благодаря массовой вакцинации, начатой в СССР в 1959 г., заболеваемость дифтерией в стране к 1966 г. по сравнению с 1958 г. была снижена в 45 раз, а ее показатель в 1969 г. составил 0,7 на 100 000 населения. Последовавшее в 80-х гг. ХХ в. снижение объема прививок привело к тяжелым последствиям. В 1993 – 1996 гг. Россию охватила эпидемия дифтерии. Болели взрослые, в основном не получившие прививок, и дети. В 1994 г. было зарегистрировано почти 40 тыс. больных. В связи с этим была возобновлена массовая вакцинация. В этот период были привиты 132 млн человек, в том числе 92 млн взрослых. В 2000 – 2001 гг. охват детей прививками в установленный срок составил 96 %, а ревакцинацией – 94 %. Благодаря этому уровень заболеваемости дифтерией в 2001 г. снизился по сравнению с 1996 г. в 15 раз. Однако для того чтобы довести уровень заболеваемости до единичных случаев, необходимо охватить вакцинацией не менее 97 – 98 % детей первого года жизни и обеспечить в последующие годы массовую ревакцинацию. Добиться полной ликвидации дифтерии в ближайшие годы вряд ли возможно из-за распространенного носительства токсигенных и нетоксигенных дифтерийных бактерий. Для решения этой проблемы также потребуется определенное время.
| <<< Назад Глава 62 Возбудители капельных инфекций |
Вперед >>> Микробиология коклюша и паракоклюша |
- Микробиология
- 38. Дифтерия. Морфология и культуральные свойства. Патогенез дифтерии
- Микробиология: словарь терминов
- Микробиология: конспект лекций
- Часть III Микробиология и другие науки
- Космическая микробиология
- Глава 27 Микробиология — основа новейших технологий
- 39. Диагностика. Профилактика. Лечение дифтерии
- Глава 25 Микробиология и космос
- Глава 14 Шахматы и микробиология
- Глава 20 Микробиология и генетика
