Книга: Самая главная молекула. От структуры ДНК к биомедицине XXI века
Технология редактирования генома
| <<< Назад Генно-инженерная фармакология |
Вперед >>> Грядущий золотой век |
Технология редактирования генома
Как я уже много раз отмечал, решающим событием, приведшем к рождению генной инженерии и вообще современной биотехнологической индустрии, было открытие ферментов рестриктаз. Рестриктазы узнают специальные последовательности в двуспиральной ДНК и наносят двунитевой разрыв в совершенно определенном месте (см. главу 4). Но рестриктазы узнают короткие последовательности, в основном состоящие всего из шести нуклеотидов, так что каждая конкретная рестриктаза нарезает геномную ДНК на множество фрагментов. Такой инструмент не годится для редактирования генома, т. е. для локального изменения текста, которое не затрагивало бы другие участки. Для этого нужен инструмент, способный с хирургической точностью сделать во всей геномной ДНК человека один разрыв.
Давайте оценим, последовательность какой длины такой инструмент должен узнавать. Будем считать для простоты, что геномная ДНК представляет собой чисто случайную последовательность четырех нуклеотидов А, Т, Г, Ц, причем все четыре нуклеотида встречаются с одинаковой вероятностью (это, конечно, грубое предположение, но для приблизительной оценки вполне годится). Тогда вероятность встретить конкретную последовательность из n нуклеотидов будет, очевидно, 4—n. Такая последовательность встретится в геноме, состоящем из N нуклеотидов, N 4—n раз. Следовательно, чтобы последовательность встретилась всего один раз, нужно, чтобы выполнялось условие: N 4—n = 1. Из этого уравнения легко находим: n = logN / log4 – и, вспомнив, что человеческий геном состоит из 3109 нуклеотидов, получаем для n значение 16. Таким образом, для того, чтобы последовательность не повторялась в геноме, т. е. была уникальной, она должна состоять не менее чем из 16 нуклеотидов. Теперь мы видим, насколько рестриктазы – негодный инструмент для редактирования генома.
Химики, биохимики и биофизики взялись за поиск адекватного инструмента, в частности, автор этих строк приложил большие усилия в этом направлении. Первой идеей было использовать способность ДНК образовывать тройную спираль, о чем мы уже говорили в главе 9. Идея казалась очень привлекательной. Достаточно выбрать целевую последовательность в геноме из, скажем, 16 нуклеотидов и синтезировать соответствующую цепь однонитевой ДНК из 16 нуклеотидов, которая образовывала бы с выбранным участком геномной ДНК тройную спираль. На один из концов синтетической ДНК можно приладить активную химическую группу или даже целый белок-эндонуклеазу, способный разрезать ДНК там, куда он доставлен. Но проблема с триплексами в том, что они образуются только в тех местах генома, в которых в одной цепи стоят одни пурины (А и Г), а, соответственно, в комплементарной цепи одни пиримидины (Т и Ц). Такие участки длиной в 16 или более нуклеотидов редко встречаются в геноме, что резко сужает выбор целевых участков для разрезания. Так что от ДНКовых триплексов пришлось отказаться.
Следующей идеей было использовать синтетический аналог ДНК, ПНК, или пептидную нуклеиновую кислоту. Этот очень интересный синтетический аналог ДНК был изобретен в 1991 году в группе Питера Нильсена в университете Копенгагена. ПНК имеет те же основания, что и ДНК, но вместо сахарофосфатного остова основания присоединены к пептидному остову, похожему на остов белковой цепи (рис. 45). Поскольку, в отличие от ДНК, ПНК не несет отрицательного заряда, две молекулы ПНК образуют с одиночной цепью ДНК очень прочные триплексы. Эти триплексы настолько прочные, что две молекулы ПНК в определенных условиях способны раскрыть двойную спираль, образовав триплекс с одной из цепей, оставив комплементарную цепь без партнера (рис. 45). У ПНК множество применений, но нас сейчас интересует одно из них, состоящее в превращении обычных рестриктаз, узнающих последовательности из шести нуклеотидов, в инструмент с гораздо большей избирательностью. Как это делается, схематически показано на рис. 45.
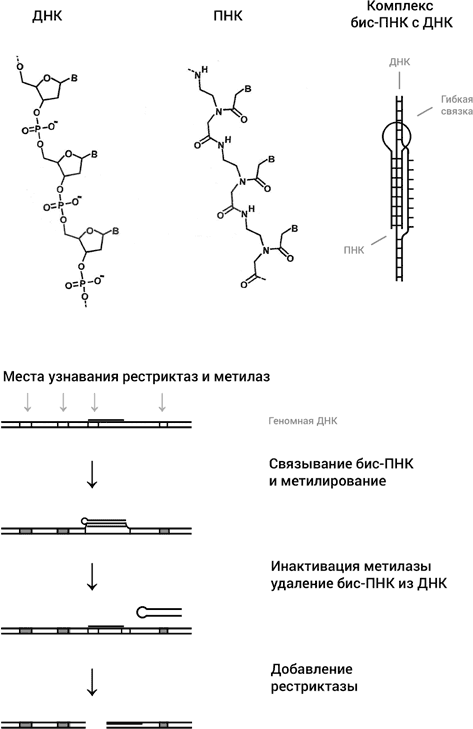
Рис. 45. ПНК имеет те же основания, что и ДНК (обозначены как В), но они прикреплены к совсем другому остову, чем в ДНК, напоминающему остов молекулы белка. Так называемая бис-ПНК, состоящая из двух коротких молекул ПНК, связанных гибкой молекулярной связкой, образует триплекс с одной из цепей ДНК (посредством триад, изображенных на рис. 42), оставляя комплементарную цепь в виде однонитевой петли. В нижней части рисунка дана схема того, как бис-ПНК используется для того, чтобы превратить обычную рестриктазу в очень редко расщепляющий ДНК инструмент
Целевой участок в геноме для связывания двух молекул ПНК с образованием триплекса выбирается таким образом, чтобы он чуть-чуть перекрывался с участком связывания какой-нибудь рестриктазы. После связывания ПНК с ДНК препарат обрабатывается соответствующей рестриктазе метилазой. Метилаза метилирует все участки узнавания в геноме, кроме одного, который стал недоступен для связывания метилазы, так как его дуплексная структура была нарушена связыванием ПНК. Затем делается так, чтобы связывание ПНК с ДНК было разрушено. В результате единственное место связывания рестриктазы с ДНК восстанавливается, тогда как все остальные места связывания не работают, поскольку они прометилированы. Теперь рестриктаза разрежет ДНК только в одном месте, в том, которое было изначально выбрано для этой цели. Конечно, мы несколько утрировали ситуацию, неметилированных участков в геноме может оказаться несколько, но ясно, что такой подход должен резко увеличивать избирательность нуклеаз, что и было экспериментально продемонстрировано в моей лаборатории в Бостонском университете в работе, выполненной совместно с Нильсеном.
Все же подход, основанный на ПНК, оказался слишком сложным, и, что самое главное, его не удавалось использовать в живой клетке. А именно редактирование ДНК непосредственно в живой клетке представляет наибольший интерес. К началу 2010 года два очень изощренных биохимические метода специфического разрезания ДНК были разработаны в биотехнологических компаниях. И их уже стали применять для редактирования геномов. Но в начале 2013 года произошел подлинный прорыв, который самым радикальным образом изменил ситуацию. Появился метод, носящий неуклюжее название КРИСПР-кас.
Метод целиком базируется на системе приобретенного иммунитета у бактерий, о котором рассказано в главе 6.
Для редактирования генома действующие лица иммунной защиты бактерий, крРНК и кас-белок, переносят в эукариотическую клетку, при этом дизайн молекулы крРНК делается с таким расчетом, чтобы промежуточная последовательность в ней была идентична выбранному участку в геномной ДНК эукариотической клетки. «Как это можно?! – слышу изумленный возглас читателя. – Система произведет двунитевой разрыв в ДНК, на этом все и закончится: клетка погибнет». Нет, не закончится. Ведь недаром мы диплоидные существа: у каждого участка нашей аутосомной ДНК есть двойник, гомологичный участок, расположенный на сестринской хромосоме. Наличие гомологичного участка позволяет нашим соматическим клеткам залечивать или, как говорят, репарировать ДНК, которая подверглась самому опасному повреждению: двунитевому разрыву. Этот механизм репарации двунитевых разрывов называется гомологичной рекомбинацией. В деталях гомологичная рекомбинация – это сложный процесс, и он происходит не только при репарации, но и в других случаях.
Для нас важно следующее: для того чтобы гомологичная рекомбинация репарировала двунитевой разрыв, необходимо, чтобы в клетки находилась ДНК с двумя последовательностями, идентичными двум последовательностям, расположенным справа и слава от места разрыва. Бактериальная ДНК гораздо более уязвима в отношении двунитевых разрывов именно потому, что бактерии – это гаплоидные существа, у них имеется только одна-единственная копия генома, и поэтому никакая гомологичная рекомбинация невозможна. Именно гомологическая рекомбинация не только спасает эукариотическую клетку от гибели, когда в клетку вводят крРНК и кас-белок, но и позволяет осуществить редактирование генома. Как это делается?
Давайте разберем ситуацию на конкретном примере. Представим себе, что мы решили осуществить генную терапию больного серповидно-клеточной анемией (СКА), о которой шла речь в главе 2 (и еще пойдет в главе 12). Иными словами, мы хотим заменить мутантный ген у больного на здоровый ген ?-цепи гемоглобина, не несущий мутацию СКА (рис. 46). Используя генную инженерию, мы готовим вектор, которым может быть плазмида или ДНК обезвреженного аденовируса. В вектор мы встраиваем следующие добавочные участки: два участка, кодирующие две молекулы крРНК, причем дизайн одной сделан так, чтобы она вызывала разрыв около левого края гена СКА, а дизайн другой сделан так, чтобы разрыв был около правого края; ген, кодирующий кас-белок. Мы размножаем взятые из пациента клетки – предшественницы красных кровяных клеток и вводим в них наш вектор, а также отрезок двунитевой ДНК, состоящий из здорового гена ?-цепи гемоглобина, не несущего мутации СКА, слева и справа от которого имеются точно такие же последовательности (они обозначены как ГЛ и ГП на рис. 46), как последовательности слева и справа от двунитевого разрыва в геномной ДНК, который получится после удаления из генома гена СКА с помощью двух молекул крРНК, которые закодированы в векторе.
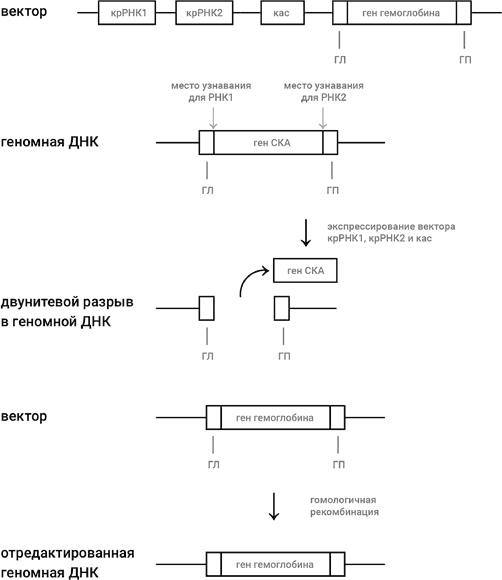
Рис. 46. Редактирование генома при помощи технологии КРИСПР-кас. Стандартными методами генной инженерии создается вектор (плазмида или обезвреженный аденовирус), в который включены гены, кодирующие две крРНК, узнающие левый и правый концы гена, который будет заменен (в нашем случае это ген СКА), ген кас и ген, на который мы хотим заменить ген СКА, т. е. в нашем случае – нормальный ген ?-цепи гемоглобина. Слева и справа от гена ?-цепи гемоглобина должны быть участки, гомологичные (т. е. идентичные) тем участкам, которые соседствуют с ним (а также с геном СКА) в геноме (они обозначены как ГЛ и ГП). Введение – вектора в клетку – предшественницу красных кровяных шариков приводит к экспрессии крРНК1, крРНК2 и кас-белка, что в свою очередь приводит к выбрасыванию гена СКА из генома и к двунитевому разрыву в ДНК, как было объяснено в главе 6 (см. рис. 25). В клетке – предшественнице красных кровяных шариков включается система репарации двунитевого разрыва, называемая «гомологичной рекомбинацией». Наличие участков ГЛ и ГП в векторе (или в отдельно введенном отрезке ДНК, несущем здоровый ген) приводит к тому, что ген ?-цепи гемоглобина переносится из вектора в образовавшуюся брешь – замена мутантного гена СКА на здоровый ген ?-цепи гемоглобина совершена
Надо только, чтобы вектор и ДНК, несущая здоровый ген, проникли в клеточное ядро, дальше все происходит само собой. Транскрибируются две молекулы крРНК и мРНК кас-белка, которая транслируется в цитоплазме, и кас-белок проникает назад в ядро. Система крРНК и кас-белка вырезает мутантный ген из генома, а репарирующая система в процессе залечивания двунитевого разрыва использует для гомологичной рекомбинации введенную ДНК, несущую здоровый ген ?-цепи гемоглобина. В результате происходит то, что мы хотели: мутантный ген заменен на здоровый (рис. 46). Осталось только вернуть отредактированные клетки назад в организм пациента, чтобы они стали производить красные кровяные клетки, содержащие нормальный, здоровый гемоглобин.
Технология редактирования генома с помощью КРИСПР-кас, как обычно обозначается описанная методика, обладает громадными преимуществами по сравнению с генной инженерией, о которой речь шла выше в этой главе, и по сравнению с другими методами редактирования генома. Главное, что эта технология позволяет резать и сшивать ДНК внутри живой клетки, причем делать это довольно просто и дешево. Конечно, имеются свои проблемы, главная из которых – это доставка в клеточное ядро крРНК и кас-белка или векторов, которые их экспрессируют. Имеется несколько способов такой доставки, но все они далеко не идеальны. Конечно, были бы гораздо лучше, если бы аналог кас-белка существовал в эукариотической клетке и требовалось бы только доставить крРНК, подобно тому, как в случае системы РНК-интерференции нужно доставить только киРНК (см. главу 12). Но пока что такие поиски не привели к успеху, и надо довольствоваться тем, что имеется, а это уже очень много.
В сотнях лабораторий во всем мире идет неустанная, подчас лихорадочная работа по использованию новой технологии редактирования генома в самых разных областях. Конечно, хотя эта методика открывает захватывающие воображение перспективы генной терапии типа нашего примера с СКА, внедрение новой технологии в медицинскую практику – это долгий путь. Хотя, как будет рассказано в главе 12, отдельные клинические испытания на безнадежно больных пациентах, которым не помогли все остальные методы лечения, уже проводятся. Но то, что продвигается с молниеносной скоростью, это применения нового метода там, где не требуется редактировать геном человека. Уже созданы новые сорта овощей и фруктов, устойчивые к гербицидам, не портящиеся при транспортировке и т. д. Сообщается, что средняя частота поступления в патентную администрацию США заявок на патенты в области КРИСПР-кас соответствует одной заявке каждый божий день.
Пожалуй, наиболее яркий пример того, в каком направлении идут исследования, – это работа, опубликованная в конце 2015 года группой исследователей во главе с Тони Ноланом из Имперского колледжа в Лондоне. Речь идет, ни много ни мало, о разработке метода уничтожения целых видов животных, которые приносят вред человеку, например комаров, переносящих малярию. Как же такое можно сделать? Хорошо известно, что малярийный плазмодий переносится только самками определенного вида комаров, поскольку только самки пьют кровь, чтобы производить потомство. Самцы совершенно безвредны. Уже давно возникла идея генетически модифицировать самцов, чтобы они несли ген бесплодия самок. Как и ген СКА, это рецессивный аутосомный ген (т. е. он находится в неполовой хромосоме), и он должен быть в гомозиготном состоянии, чтобы приводить к бесплодию (т. е. он должен присутствовать в обеих аллелях комариных клеток). Если запустить в популяцию самцов, несущих ген бесплодия во всех своих гаметах (т. е. сперматозоидах), это не приведет к бесплодию самок первого поколения. Лишь при встрече самок первого поколения с несущими ген бесплодия самцами будут рождаться бесплодные самки (и то только в половине случаев). Но при оплодотворении самок первого поколения нормальными самцами бесплодных самок не будет появляться. Так что, чтобы уменьшить популяцию комаров, нужно нарастить и выпустить в экосистему чертову уйму самцов, несущих ген бесплодия. Не очень-то эффективно получается.

Рис. 47. Использование технологии КРИСПР-кас для создания бесплодных комаров. А. Создается вектор, содержащий конструкцию, состоящую из гена бесплодия, гена крРНК и гена кас. На левом и правом концах конструкция имеет два участками, ГЛ и ГП, которые в геноме комара находятся слева и справа от участка, узнаваемого молекулой крРНК. Этот вектор вводится в комариного самца, и в результате гаметы самца несут всю конструкцию. Б. Когда такой ГМО-комар оплодотворяет нормальную самку, зигота сначала оказывается гетерозиготной относительно всей конструкции. Однако вскоре после возникновения зиготы в ней происходит экспрессия генов крРНК и кас в отцовской хромосоме, в результате чего нормальная материнская хромосома оказывается отредактированной: в нее переносится из отцовской хромосомы вся конструкция. Возникает гомозиготный комар. Если это самец, то у него все сперматозоиды несут конструкцию, если это самка, то она к тому же бесплодна
Ну а что дает технология редактирования генома? Нолан с соавторами ввели в самцов вектор, содержащий ген крРНК, ген, кодирующий кас-белок, и ген бесплодия. Дизайн крРНК был таким, что двунитевой, разрыв должен был происходить в месте на хромосоме, где должен быть размещен ген бесплодия. На левом и правом концах конструкция из трех генов содержала две последовательности, гомологичные последовательностям, расположенным слева и справа от места разрыва (рис. 47). Экспрессия вектора в клетках самца приводит, очевидно, к тому, что вся конструкция (назовем ее КРИСПР-конструкцией), расположенная между двумя концевыми последовательностями, встраивается в геном комара. Что происходит, когда такой генно-модифицированный самец (ГМО-комар), несущий КРИСПР-конструкцию в своих гаметах, выпускается в популяцию нормальных малярийных комаров? Он оплодотворяет самку, не несущую гена бесплодия, и все потомки первого поколения, и самцы, и самки, должны, согласно законам Менделя, быть гетерозиготами. Но уже в зиготе потомков первого поколения происходит экпрессия КРИСПР-конструкции, в результате чего в доставшуюся от самки нормальную хромосому вставляется вся КРИСПР-конструкция, включая ген бесплодия. Зачатые как гетерозиготы, комары уже в первом поколении превращаются в гомозиготы в отношении гена бесплодия!
Такие гомозиготные самки бесплодны, а гомозиготные самцы чувствуют себя совершенно нормально и готовы к оплодотворению. Причем все гаметы самцов будут нести КРИСПР-конструкцию. Так, через несколько поколений ген бесплодия завладевает популяцией, в ней не остается плодовитых самок. Популяция малярийных комаров вымирает. Такое развитие событий немыслимо с точки зрения канонических законов Менделя и с точки зрения популяционной генетики. Начав с ниспровержения запрета на наследование благоприобретенных признаков у бактерий, система КРИСПР-кас при перенесении на животных ниспровергла законы Менделя и законы популяционной генетики. Слыханное ли дело: зачатая как гетерозигота вдруг превращается в гомозиготу, а ген бесплодия завладевает всей популяцией! И это все не фантазии и не прожекты – такие ГМО-комары уже существуют в лаборатории Нолана. Успешное создание ГМО-комаров ясно иллюстрирует, насколько радикальным шагом является технология редактирования генома КРИСПР-кас по сравнению с генной инженерией. Главное различие в том, что редактирование генома происходит в живой клетке и поэтому удается ввести в действие автономную программу геномной перестройки, которая сама включается вновь и вновь в каждом поколении, без вмешательства экспериментатора, и представляет собой вопиющее нарушение законов классической генетики.
Так что же, проблема малярии решена? С научной точки зрения – да. Мы оказались перед очень трудным выбором. С одной стороны, ясно, что надо немедленно запустить ГМО-самцов в гущу малярийных комаров где-нибудь в Африке. Но, с другой стороны, имеется опасность, что КРИСПР-конструкция, несущая ген бесплодия, передастся от комаров, распространяющих малярию, к обычным, безвредным комарам, которые являются неотъемлемой частью экосистемы. Ими и их личинками питаются рыбы и лягушки; наверное, они играют еще какую-то роль. Хотим ли мы их уничтожения? Как обычно, эксперты разделились на два лагеря. Одни призывают не спешить и сначала попытаться уяснить в полной мере возможные риски. Другие говорят, что это тот случай, когда бездействие преступно: ведь каждый день от малярии умирает около 1000 человек, почти все – в Северной Африке. Очень трудный выбор… И такого рода труднейшие вопросы будут нарастать как снежный ком, по мере дальнейшего внедрения технологии редактирования генома. Конечно, можно поступить, как это сделала Государственная дума в России: вообще запретить все ГМО, да и дело с концом. Когда я узнаю о таких новостях, я вспоминаю собственные слова, которые люблю повторять моим студентам. «Есть болезнь пострашнее рака, инфаркта, чумы, холеры и даже СПИДа: имя ее – невежество. И болезнь эта неизлечима».
К счастью, наряду с вопиющими невеждами среди представителей вида Homo sapiens встречаются индивидуумы, способные на поразительные прозрения. Одним из таких людей был Уоррен Уивер, чьи воистину пророческие слова взяты эпиграфом к этой главе. Это тот самый Уивер, который в 1932–1955 годах возглавлял отдел естественных наук Фонда Рокфеллера и который в 1937 году сумел осуществить переезд Дельбрюка из Германии в США (см. главу 1). Кто знает, насколько бы задержалось открытие структуры ДНК, которое было началом всего, о чем рассказано в этой книге, не окажись такой человек, как Уивер, в нужное время в нужном месте. Ведь Уотсон произошел из фаговой группы Дельбрюка…
| <<< Назад Генно-инженерная фармакология |
Вперед >>> Грядущий золотой век |
- 10 Генная инженерия и технология редактирования генома. Опасения и надежды
- 33. Биотехнология: достижения и перспективы развития
- 3.9. Биотехнология, клеточная и генная инженерия, клонирование. Роль клеточной теории в становлении и развитии биотехнол...
- 3.9.1. Клеточная и генная инженерия. Биотехнология
- 3.19. Биотехнология: достижения и перспективы развития
