Книга: Биохимия старения
Иммунная компетентность и заболевания
| <<< Назад Возрастные изменения иммунной системы |
Вперед >>> Резюме |
Иммунная компетентность и заболевания
Частота инфекций, аутоиммунных заболеваний и рака в пожилом возрасте увеличивается. Поскольку снижается главным образом функция Т-, а не В-клеток, должна, вероятно, существовать корреляция между частотой этих заболеваний и компетентностью Т-клеток [16, 68, 107, 121].
Аутоиммунные заболевания
Предполагают, что аутоиммунные заболевания вызываются неспособностью иммунокомпетентных клеток распознавать другие клетки собственного организма; в этом случае к клеткам хозяина вырабатываются иммуноглобулины, как если бы они были "чужими". Аутоантитела разрушают ткани и приводят к аутоиммунным заболеваниям. Возможно, это обусловлено нарушением функции Т-супрессоров, которые считаются ответственными за аутотолерантность [20]. Хирокава и др. [50] сообщили, что у мышей активность Т-супрессоров с возрастом снижается. Возможно, что иммунокомпетентные В-клетки не реагируют на собственные клетки в раннем возрасте по той причине, что Т-супрессоры предотвращают эту реакцию, а не потому, что все В-клетки, которые "ошибаются", исчезают в раннем периоде развития. Так как число и функция Т-супрессоров при старении снижаются, те В-клетки, активность которых была ранее подавлена, начинают реагировать на клетки хозяина, вырабатывая к ним антитела и вызывая аутоиммунные заболевания. Это, однако, не объясняет, почему функция Т-супрессоров при старении снижается.
Индивидуумы, страдающие от аутоиммунных заболеваний, по-видимому, предрасположены к ним генетически. Тиреотоксикоз (болезнь Грейвса), спонтанная недостаточность надпочечников (аддисонова болезнь), пернициозная анемия, ревматоидный артрит, сахарный диабет взрослых и старческий амилоидоз являются аутоиммунными болезнями, которые преобладают в старческом возрасте. Вместе с тем красная волчанка, склеродермия и мышечная дистрофия — это аутоиммунные болезни, которые возникают в молодом возрасте. Аутоиммунные заболевания часто связаны также с вирусными инфекциями. Мыши, тимэктомированные сразу после рождения, имеют высокую частоту аутоиммунных заболеваний [82].
Изучение генетики иммунной системы, особенно тимус-зависимых иммунных функций, уже внесло некоторую ясность в понимание причин аутоиммунитета. Все позвоночные имеют гены главного комплекса тканевой совместимости (МНС; от англ. major histocompatibility complex). У мышей он называется Н-2 и расположен в хромосоме 17. У человека он называется системой HLA и расположен в хромосоме 6. МНС содержит группу из нескольких сотен генетических локусов и поэтому является примером супергена. Он контролирует и регулирует иммунный ответ, особенно тимус-зависимые функции [105, 123, 124]. Было сделано предположение, что МНС участвует в процессе старения [122]. Система Н-2 мышей содержит гены, контролирующие развитие специфических Т-супрессоров для иммунорегуляции цитотоксической реакции лимфоцитов, способность к развитию иммунного ответа на определенные антигены, восприимчивость к некоторым вирусам, аутоиммунные болезни, скорости снижения различных иммунных реакций, систему комплемента, возможно, систему для распознавания "своего" [8], кооперацию клеток Т — В и экспрессию тета-антигена в Т-клетках.
Поскольку почти все перечисленные функции в старческом возрасте нарушаются, анализ системы МНС может пролить некоторый свет на механизмы этих нарушений. Смит и Уолфорд [106] провели анализ продолжительности жизни семи линий мышей, конгенных по системе Н-2. Мыши с наибольшей продолжительностью жизни имели самую высокую реакцию на фитогемагглютинин (ФГА) в течение всей жизни. Линии с наименьшей продолжительностью жизни давали самую низкую реакцию. Поскольку система Н-2 ответственна за реакцию на ФГА, эти результаты указывают на изменения в данной системе генов, которая может не только контролировать иммунный ответ, но и влиять на продолжительность жизни.
Реакция лимфоцитов на чужеродные или измененные клетки, в том числе трансплантаты тканей, включает раннюю фазу, когда лимфоциты распознают трансплантат как антиген. Эта фаза носит название реакции смешанных лимфоцитов (MLR; от англ. mixed lymphocyte reaction), которая контролируется у мышей генами локуса Ia системы Н-2. За распознаванием следует образование Т-киллеров, осуществляющих клеточно-опосредованную лимфоцитотоксичность (CML; от англ. cellmediated lymphocytotoxicity), в процессе которой чужеродные клетки лизируются и разрушаются. Эта реакция контролируется K- и D-локусами системы Н-2 мышей и А- и В-локусами системы HLA человека. Сообщают, что MLR у старых мышей составляет едва одну треть от уровня реакции взрослых животных [63], a CML снижается еще больше [38].
Гуморальный иммунный ответ, который требует Т-кооперации, также заметно снижается с возрастом [61, 73]. Т-супрессоры, которые важны для регуляции иммунного ответа и для предупреждения развития аутоиммунитета, контролируются 1-локусом системы МНС у мышей [105]. Есть сообщение, что активность Т-супрессоров в MLR у старых мышей увеличивается [102], хотя Хирокава и др. [50] отмечают общее снижение активности этих клеток у старых мышей. Их число падает у короткоживущих новозеландских черных мышей (NZB), чувствительных к аутоиммунным расстройствам [114]. Эти исследования показывают, что тимус-зависимые иммунные реакции с возрастом ослабевают, так же как функция Т-хелперов и Т-супрессоров. О тимус-независимых реакциях как функции возраста информация очень скудна.
У людей, страдающих сахарным диабетом взрослых, наблюдаются признаки ускоренного старения: артериосклероз в раннем возрасте, повышение уровня аутоантител и амилоидоз островков Лангерганса. При этом заболевании отмечено также повышение активности гена HLA-B8 системы МНС [118]. Таким образом, между активностью системы МНС и аутоиммунным заболеванием имеется корреляция. Основной вопрос заключается в том, на какие факторы влияет система МНС в пожилом возрасте.
Другие примеры аутоиммунных заболеваний, которые связаны с системой МНС, можно наблюдать у людей, страдающих амилоидозом и наследственной атаксией — телеангиэктазией, обычными болезнями пожилого возраста [121]. Амилоид — это гиалиновый продукт, который откладывается в межклеточном веществе. Предполагают, что амилоидоз обусловлен снижением функции Т-клеток и некоторым усилением функции В-клеток. Наследственная атаксия — телеангиэктазия у человека является иммунодефицитным заболеванием, которое контролируется рецессивным геном. Обычно болезнь проявляется в 6-летнем возрасте, когда у больных исчезают сывороточные и секреторные иммуноглобулины А и Е, уменьшается тимус, наблюдается дефицит клеточного иммунитета. С возрастом для таких больных характерна склонность к развитию опухолей, раннее поседение и ослабление функций половых желез.
Предполагают несколько причин повышения частоты аутоиммунных заболеваний и Т-дефицита в пожилом возрасте: а) усиление иммунной реактивности, вызываемой, возможно, активацией генов иммунного ответа системы МНС; б) повреждение тимуса; в) дефект клеток-мишеней, который приводит к такому изменению их поверхности, что лимфоциты принимают их за "чужие" клетки, и г) происходящий в результате снижения числа Т-супрессоров выход в кровоток некоторых запрещенных клонов лимфоцитов, который находится под контролем супрессорных или регуляторных Т-клеток. Даже если считать эти факты убедительным доказательством взаимосвязи аутоиммунитета и функции тимуса, все же неясно, приводит ли снижение функции иммунной системы к развитию аутоиммунитета или наоборот.
Рак
Частота рака у больных с пониженной иммунной функцией выше, чем средняя. Как у людей, так и у животных вероятность появления опухолей к старости повышается [13, 86, 117]. Известно, что инфекционные и аутоиммунные заболевания чаще встречаются у людей с иммунодефицитами, у которых нарушен главным образом клеточный иммунитет [68, 97]. Это подтверждается следующими данными. Если у больного в условиях иммунодепрессивной терапии развивается аллогенная опухоль, то после прекращения терапии такая опухоль отторгается [86], т. е. иммунодефицит предрасполагает к развитию опухолей. Дальнейшее подтверждение этой связи вытекает из следующих наблюдений: если мышь заразить латентным вирусом, то иммунная система подавляется [53]; заражение мышей вирусом лейкоза подавляет иммунный ответ [30]; у короткоживущих мышей опухоли и аутоиммунные болезни появляются до снижения иммунной функции [80, 132]; продолжительность жизни короткоживущих мышей линии AKR с тимомой после удаления тимуса удваивается [77, 84]; у короткоживущих мышей линии NZB, которые погибают от аутоиммунного заболевания, снижение функции иммунитета прямо связано с уменьшением числа Т-клеток. Таким образом, доступные в настоящее время данные говорят в пользу того, что при снижении иммунной функции в пожилом возрасте не только повышается восприимчивость животных и человека к инфекционным заболеваниям, но увеличивается склонность к аутоиммунным заболеваниям и к развитию опухолей. Если система МНС и участвует в индукции рака, то причина изменений ее функции остается невыясненной.
Имеется ряд примеров, подтверждающих корреляцию между дефицитом иммунокомпетенции и неоплазией. Частота рака примерно в 10–20 раз выше у людей, которые с детства имеют иммунодефицит. Хотя они живут недолго, у них наблюдают высокую заболеваемость раком [108]. Частота рака у людей, имеющих иммунодефицит во взрослом состоянии, также выше, чем у обычных людей [31, 108]. Больные, которым вводили антилимфоцитарную сыворотку (АЛС), имеют более высокую заболеваемость раком потому, что, как полагают, АЛС специфически подавляет функцию Т-клеток [109]. После иммунодепрессии частота спонтанных опухолей у животных и человека возрастает примерно в 350 раз. К тому же после иммунодепрессии у животных легче приживаются трансплантаты опухолей, а частота метастазов пересаженных опухолей выше [83, 108]. Смертность у людей, имеющих дефицит клеточного иммунитета, выше, чем у обычных людей.
Причина высокой частоты неоплазий при иммунодефиците неизвестна. Высказано предположение, что "иммунный надзор" необходим для элиминации злокачественных клеток, которые могут нести "не свои" антигены [13]. Считается, что злокачественное заболевание возникает из-за ослабления в пожилом возрасте Т-клеточного надзора, в результате чего появляются злокачественные клетки. Однако исследование Т-дефицитных мышей (мыши, родившиеся с дефектным тимусом) показало, что Т-клетки не существенны для надзора за некоторыми опухолевыми клетками [110, 111]. Другая возможность заключается в том, что при иммунодефиците онкогенные вирусы лучше размножаются, так как усиление активности Т-супрессоров при неопластических заболеваниях препятствует действию Т-киллеров, которые осуществляют надзор. Итак, взаимосвязь злокачественных заболеваний с иммунодефицитом не вызывает сомнений, но что из них является следствием, а что — причиной, пока неизвестно; механизм, посредством которого одно может влиять на другое, остается невыясненным.
Ослабление функции тимуса
Несколько авторов сообщили о том, что структурная и функциональная инволюция тимуса заканчивается в периоде, предшествующем завершению роста. Морфологические исследования Эндрью [4] и Сантисбибена [101] показали, что вес лимфоидной ткани тимуса начинает снижаться вскоре после достижения половой зрелости. Это происходит главным образом за счет атрофии коркового вещества (рис. 7.12); затем следует снижение уровня тимозина и числа Т-клеток [59]. Сколько-нибудь заметного уменьшения размеров лимфатических узлов и селезенки не наблюдали, но число центров размножения в этих органах снижается [16, 59, 89]. Количество циркулирующих Т-клеток прогрессивно падает после прохождения зрелого возраста, а их число у 60-70-летних людей составляет только ~70 % уровня, характерного для молодых [5, 22, 96]. У мышей функция Т-клеток при старении также снижается [38, 39, 68, 88, 112, 116]. Устойчивость к аллогенным опухолевым клеткам и пролиферативный ответ клеток селезенки на аллогенные клетки с возрастом быстро падают [88].
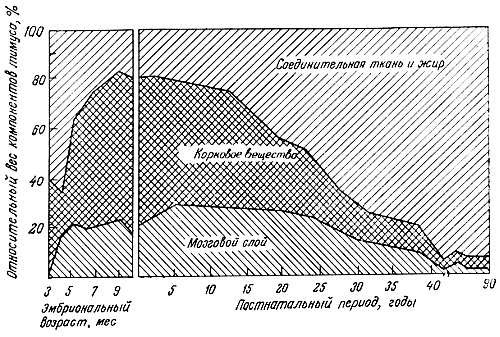
Рис. 7.12. Возрастные изменения компонентов тимуса человека [9]
Т-клетки проходят через тимус. Тимус подвергается обратному развитию вскоре после достижения половой зрелости, и этому сопутствует снижение определенных функций иммунитета. Предполагают, что ослабление иммунной функции вызвано уменьшением активности тимуса. Некоторые экспериментальные данные подтверждают это предположение. Снижение тимус-зависимых функций иммунитета возникает в период половой зрелости, когда тимус начинает подвергаться инволюции, и, следовательно, задолго до того, как проявляются иммунодефицитные заболевания пожилого возраста [74]. Иммунодефицит, амилоидоз и аутоиммунитет у неонатально тимэктомированных и генетически восприимчивых мышей можно предупредить или устранить пересадкой тимуса от молодых сингенных но не от старых мышей [26, 134]. Системная красная волчанка и рассеянный склероз у человека [40], а также патология мышей NZB, которая напоминает системную красную волчанку, вероятно, вызваны реакцией хозяина на некоторые вирусные антигены [78, 130]. Заболевание у мышей NZB развивается после снижения Т-ответа [110]. Начало этого заболевания можно замедлить введением тимоцитов молодых сингенных мышей [35]. У человека синтез антител к ядрам клеток, который является Т-зависимым, с возрастом усиливается [99].
Если считать, что частота рака в обычной популяции только 1:300, то у людей с иммунодефицитами, выявленными в детстве, она составляет 1:20, несмотря на то что продолжительность периода, в течение которого обычно развивается рак, у них меньше [31]. Как у животных, так и у человека иммунодепрессия под действием лекарств способствует увеличению заболеваемости раком [11]. Например, риск развития ретикулосаркомы у больных с иммунодепрессией примерно в 350 раз выше, чем у здоровых людей. Иммунодепрессия способствует приживлению пересаженных опухолей, а также метастазированию у человека и у животных [11, 135]. У людей со сниженным клеточным иммунитетом более высокая смертность, чем в общей популяции [69, 97]. Все эти наблюдения свидетельствуют о том, что с возрастом Т-клеточная функция нарушается, и это приводит к увеличению частоты рака, аутоиммунных и других заболеваний. Замедление или предупреждение снижения функции Т-клеток может отсрочить начало этих заболеваний или по крайней мере облегчить их протекание и тем самым замедлить процесс старения.
Некоторые данные, полученные in vitro, подтверждаются наблюдениями in vivo. Пролиферативный ответ Т-клеток на растительные митогены ФГА и конканавалин А у мышей и человека с возрастом значительно снижается [1, 29, 41, 56, 63, 88, 90, 97]. Вряд ли это обусловлено уменьшением связывания митогенов с рецепторами клеточных мембран [54], так как количество 125I-ФГА одинаково в молодых и старых клетках. Причиной могут быть молекулярные изменения, поскольку известно, что уровень циклического ГМФ (cGMP) после стимуляции митогеном в старых клетках увеличивается меньше, чем в молодых [45]. Правда, Эгервол и др. [2] сообщают, что при 37 °C ФГА одинаково стимулирует к делению и молодые, и старые клетки. Митотическая активность была изучена по включению 3Н-тимидина (рис. 7.13). Точность считывания ДНК-полимеразой в лимфоцитах двух доноров разного возраста тоже была одинаковой, хотя "старый" фермент оказался более термолабильным. Известно, кроме того, что ацетилирование гистонов в лимфоцитах, стимулированных ФГА, с возрастом снижается [85]. У мышей по мере старения замедляется образование цитотоксических лимфоцитов в смешанной культуре [47] и ослабевает функция Т-хелперов [42, 46, 91, 92].
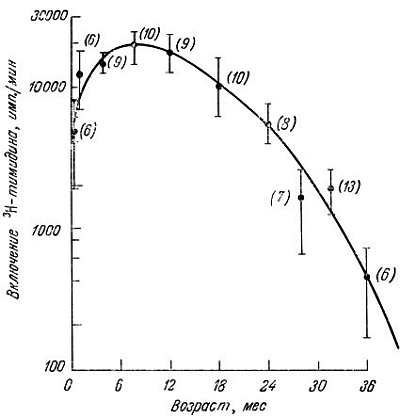
Рис. 7.13. Снижение митогенного ответа на фитогемагглютинин со стороны Т-клеток селезенки долгоживущих мышей [52]
Тимэктомия у взрослых мышей способствует снижению их иммунного ответа, что заметно по ослабленной реакции трансплантата против хозяина, уменьшению уровня антител, вырабатываемых к бычьему сывороточному альбумину, ослабленному ответу на ФГА и плохому общему состоянию [79, 115]. Когда тимус мыши-донора в возрасте от 1 дня до 33 мес пересаживают бестимусным молодым реципиентам, наблюдают снижение с возрастом донора дифференциации или созревания клеток-предшественников с образованием функционально активных Т-клеток у реципиента. При этом вторичное заселение лимфоцитами органов реципиента и реактивность его Т-клеток к ФГА резко уменьшаются.
Кэй [55, 56] наблюдала прекращение миграции стволовых клеток в тимус у мышей после 6–8 нед. Это может быть причиной снижения выработки дифференцированных Т-клеток типа хелперов, супрессоров и киллеров, обеспечивающих специфические иммунные реакции, что подтверждается следующими наблюдениями. Доля Т-клеток, несущих тета-антиген, с возрастом снижается, так же как и число тета-антигенов на поверхности клетки [12]. Продолжительность жизни короткоживущих карликовых мышей с гипофункцией гипофиза может быть увеличена с 4 до 12 мес введением клеток лимфатических узлов, но не костного мозга или тимоцитов [26]. Это указывает на то, что снабжение специализированными клетками лимфатических узлов, которое требуется для нормальной иммунной функции, прекращается в раннем периоде жизни и что благодаря восполнению этих клеток животные приобретают защиту от болезней и их продолжительность жизни увеличивается. Уровень тимусного гормона (тимозина) в сыворотке начинает снижаться после инволюции тимуса [6]. Этот гормон требуется для дифференцировки Т-клеток. Описанные исследования свидетельствуют о том, что с возрастом нарушается функция тимуса, который отвечает за предохранение организма от инфекционных и аутоиммунных заболеваний, а также от рака. Следовательно, может происходить постепенное ослабление устойчивости организма к указанным заболеваниям, что приводит к снижению жизнеспособности. Однако нарушения функции характерны не только для тимуса, они отмечаются почти во всех органах. Итак, главный вопрос остается открытым: как и почему нарушается функция тимуса после достижения половой зрелости? Другая группа клеток, включающая главным образом макрофаги, играет вспомогательную роль в иммунном ответе. Как именно они вовлекаются в иммунные реакции, неизвестно. По своей природе они являются фагоцитами и обычно противостоят антигенам до встречи последних с В- и Т-клетками. С возрастом фагоцитарная активность перитонеальных вспомогательных клеток мышей не меняется; об этом свидетельствует активность лизосомных ферментов: катепсина D, ?-глюкуронидазы и кислой фосфатазы. То же самое можно сказать и об их способности индуцировать антителообразование [44, 87]. Вспомогательные клетки селезенки также не теряют способность кооперироваться с В- и Т-клетками, необходимую для инициации иммунного ответа [46].
Попытки коррекции иммунной функции
Поскольку к старости функция иммунитета ослабевает и одновременно увеличивается частота инфекционных и аутоиммунных заболеваний, а также склонность к развитию опухолей, полагают, что возникновение этих заболеваний можно предупредить или отсрочить улучшением иммунного статуса животного. Для усиления иммунокомпетентности организма после достижения половой зрелости был предложен ряд мер: изменение рациона, пересадка иммунокомпетентных клеток, оперативное вмешательство, применение лекарственных препаратов и понижение температуры тела. Мак-Кей и др. [76] первыми сообщили, что при снижении калорийности пищи продолжительность жизни крыс значительно увеличивается. Уолфорд и др. [125] показали, что при ограниченной калорийности пищи иммунная система у крыс развивается медленно и также медленно ослабевает. Таким образом, рацион влияет на скорость развития и угасания иммунной функции. Было показано также, что в указанных экспериментальных условиях отдаляется момент возникновения старческих болезней [98]. Пища с низким содержанием жира, но богатая белком, способствует подавлению развития аутоиммунных заболеваний и увеличению продолжительности жизни мышей [28]. Изменением рациона иммунная функция может быть улучшена на определенный период, но в конце концов она снижается.
Пересадка большого числа клеток (108 клеток на одно животное) лимфатических узлов молодой мыши короткоживущему реципиенту с гипофизарной карликовостью и недостаточностью гормона роста увеличивает продолжительность его жизни в 3–4 раза [26]. Очевидно, клетки лимфатических узлов стимулируют функцию гипофиза или выполняют некоторые гипофиз-зависимые функции. После упомянутой выше пересадки у мышей NZB их продолжительность жизни увеличивалась только на 1 мес [65], а развитие заболеваний не предотвращалось [131]. Введение клеток тимуса молодых мышей старым животным линии A/J препятствовало появлению некоторых типов аутоантител, но продолжительность жизни при этом увеличивалась незначительно [133]. Однако когда клетки тимуса и костного мозга одновременно пересаживали от молодых старым мышам, то иммунный статус последних существенно улучшался и их продолжительность жизни увеличивалась [49, 71].
В качестве хирургических методов исправления иммунного статуса было предложено удаление тимуса и селезенки. Фюрт [33] показал, что если удалить тимус у мыши линии AKR, восприимчивой к тимоме, перед появлением признаков опухоли, то продолжительность жизни животного увеличивается. Удаление селезенки у мыши линии BC3F1 в 2-летнем возрасте непосредственно перед развитием ретикулосаркомы также приводит к увеличению продолжительности ее жизни (в 2 раза) [3]. Создается впечатление, что селезенка является местом развития вирус-зависимой опухоли, причем хирургическим путем не только можно предотвратить появление опухоли, но и увеличить продолжительность жизни.
Для улучшения иммунной компетентности старых животных использовали многие препараты, в том числе гормоны. Применение гормона тимуса быка увеличивает продолжительность жизни короткоживущих, восприимчивых к аутоиммунным заболеваниям мышей [21], но подобный эффект отсутствует для долгоживущих мышей [94]. Химические препараты типа меркаптоэтанола, полинуклеотидов, витамина Е и полиионов несколько усиливают иммунную функцию (ссылки см. в работе [60]), но основания для применения таких препаратов недостаточны, так как проведенные исследования еще не позволяют глубоко разобраться в причинах старения.
Продолжительность жизни рыб значительно увеличивается, если их содержать при низкой температуре, особенно во второй половине жизни [34, 67]. Причиной может быть снижение скорости метаболизма, что способствует замедлению старения. При низкой температуре метаболизм подавляется и одновременно замедляется созревание иммунной системы. Если этот способ применить на ранних стадиях развития, то можно достичь увеличения продолжительности жизни.
Более строгий подход к улучшению иммунного статуса животных заключается в пересадке иммунокомпетентных клеток молодых доноров старым совместимым реципиентам. Если клетки донора будут нормально функционировать в течение длительного времени, то старое животное будет меньше болеть и проживет дольше. Поэтому необходимо типировать по антигенам тканевой совместимости иммунокомпетентные клетки и молодых доноров, и старых реципиентов, как это требуется при переливании крови. Еще более реальным и эффективным методом может стать хранение иммунокомпетентных клеток больных, взятых у них в юности, и переливание этих клеток тем же людям, когда они состарятся. Так можно избежать реакции трансплантата против хозяина. Клетки селезенки остаются живыми даже после хранения в течение 16 лет [70]. Есть данные о том, что стволовые клетки и ткань тимуса молодых мышей, пересаженные старым мышам, увеличивают продолжительность жизни последних [51].
| <<< Назад Возрастные изменения иммунной системы |
Вперед >>> Резюме |
