Книга: Общая химия
85. Константа диссоциации.
| <<< Назад 84. Степень диссоциации. Сила электролитов. |
Вперед >>> 86. Сильные электролиты. |
85. Константа диссоциации.
К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение константы равновесия. Например, для диссоциации уксусной кислоты
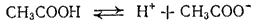
константа равновесия имеет вид
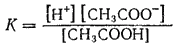
Здесь в числителе дроби стоят концентрации ионов —продуктов диссоциации, а в знаменателе — концентрация недиссоциированных молекул.
Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации. Величина К зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора. Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем выше К, тем легче электролит диссоциирует.
Многоосновные кислоты, а также основания двух- и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда. Например, диссоциация угольной кислоты происходит в две ступени:
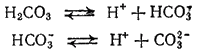
Первое равновесие — диссоциация по первой ступени — характеризуется константой диссоциации, обозначаемой K1,
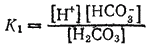
- 230 -
а второе — диссоциация по второй ступени — константой диссоциации K2:
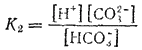
Суммарному равновесию
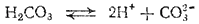
отвечает суммарная константа диссоциации К:
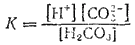
Величины K, K1 и K2 связаны друг с другом соотношением:
K=K1K2
Аналогичные соотношения характеризуют и ступенчатую диссоциацию оснований многовалентных металлов. Например, двум ступеням диссоциации гидроксида железа (II)
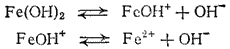
отвечают константы диссоциации:
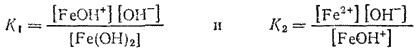
Суммарной диссоциации
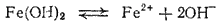
отвечает константа:

При этом
K=K1K2
При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в меньшей степени, чем по предыдущей (по второй меньше, чем по первой и т. д.). Иначе говоря, соблюдается неравенство:
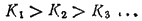
Это объясняется тем, что энергия, которую нужно затратить для отрыва иона, минимальна при его отрыве от нейтральной молекулы и становится больше при диссоциации по каждой следующей ступени.
Если обозначить концентрацию электролита, распадающегося на два иона, через С, а степень его диссоциации в данном растворе через ?, то концентрация каждого из ионов будет C?, а концентрация недиссоциированных молекул C(1-?). Тогда уравнение константы диссоциации принимает вид:
- 231 -
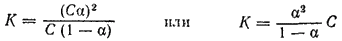
Это уравнение выражает закон разбавления Оствальда. Оно дает возможность вычислять степень диссоциации при различных концентрациях электролита, если известна его константа диссоциации. Пользуясь этим уравнением, можно также вычислить константу диссоциации электролита, зная его степень диссоциации при той или иной концентрации.
Для растворов, в которых диссоциация электролита очень мала, уравнение закона Оствальда упрощается. Поскольку в таких случаях ? ? 1, то величиной ? в знаменателе правой части уравнения можно пренебречь. При этом уравнение принимает вид:
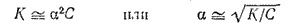
Это уравнение наглядно показывает связь, существующую между концентрацией слабого электролита и степенью его диссоциации: степень диссоциации возрастает при разбавлении раствора.
Полученный вывод вытекает из природы явления диссоциации. Как всякое химическое равновесие, равновесие в растворе слабого электролита является динамическим, т. е. при его установлении протекают с равными скоростями два процесса: процесс диссоциации и обратный ему процесс образования молекул из ионов. При этом разбавление раствора не препятствует первому из этих процессов — диссоциации. Однако процесс образования молекул из ионов в результате разбавления затрудняется: для образования молекулы должно произойти столкновение ионов, вероятность которого с разбавлением уменьшается.
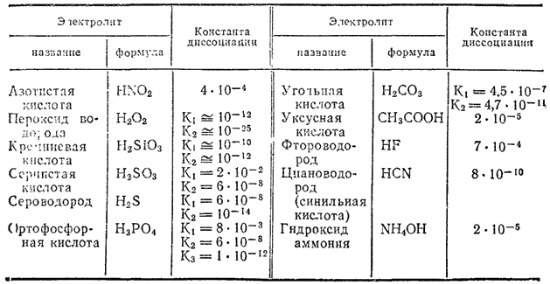
Таблица 12. Константы диссоциации некоторых слабых электролитов в водных растворах при 25°C
- 232 -
В табл. 12 приведены значения констант диссоциации некоторых слабых электролитов.
| <<< Назад 84. Степень диссоциации. Сила электролитов. |
Вперед >>> 86. Сильные электролиты. |
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- Концентрация глюкозы в крови – важнейшая константа
- Универсальная константа под вопросом
- 83. Процесс диссоциации.
- 82. Теория электролитической диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- На языке физической химии
- Чрезмерная нагрузка на кончик пера
- 169. Спирты и фенолы.
