Книга: Общая химия
82. Теория электролитической диссоциации.
| <<< Назад 81. Особенности растворов солей, кислот и оснований. |
Вперед >>> 83. Процесс диссоциации. |
82. Теория электролитической диссоциации.
Аррениус обратил внимание на тесную связь между способностью растворов солей, кислот и оснований проводить электрический ток и отклонениями растворов этих веществ от законов Вант-Гоффа и Рауля. Он показал, что по электрической проводимости раствора можно рассчитать его осмотическое давление, а следовательно, и поправочный коэффициент i. Значения i, вычисленные им из электрической проводимости, хорошо совпали с величинами, найденными для тех же растворов иными методами.
Причиной чрезмерно высокого осмотического давления растворов электролитов является, согласно Аррениусу, диссоциация электролитов на ионы. Вследствие этого, с одной стороны, увеличивается общее число частиц в растворе, а следовательно, возрастают осмотическое давление, понижение давления пара и изменения температур кипения и замерзания, с другой — ионы обусловливают способность раствора проводить электрический ток.
Эти предположения в дальнейшем были развиты в стройную теорию, получившую название теории электролитической диссоциации. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называются катионами; к ним относятся, например, ионы водорода и металлов.
Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков и гидроксид-ионы. Как и молекулы растворителя, ионы в растворе находятся в состоянии неупорядоченного теплового движения.
Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. Например, диссоциация HCl выразится уравнением:
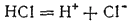
Распад электролитов на ионы объясняет отклонения от законов Вант-Гоффа и Рауля, о которых говорилось в начале этой главы. В качестве примера мы приводили понижение температуры замерзания раствора NaCl. Теперь нетрудно понять, почему понижение температуры замерзания этого раствора столь велико. Хлорид натрия переходит в раствор в виде ионов Na+ и Cl-. При этом из одного моля NaCl получается не 6,02·1023 частиц, а вдвое большее их число. Поэтому и понижение температуры замерзания в растворе NaCl должно быть вдвое больше, чем в растворе неэлектролита той же концентрации.
Точно так же в очень разбавленном растворе хлорида бария, диссоциирующего согласно уравнению
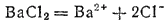
осмотическое давление оказывается в 3 раза больше, чем вычисленное по закону Вант-Гоффа, так как число частиц в растворе в 3 раза больше, чем если бы хлорид бария находился в нем в виде молекул BaCl2.
Таким образом, особенности водных растворов электролитов, противоречащие с первого взгляда законам Вант-Гоффа и Рауля, были объяснены на основе этих же законов.
Однако теория Аррениуса не учитывала всей сложности явлений в растворах. В частности, она рассматривала ионы как свободные, независимые от молекул растворителя частицы. Теории Аррениуса противостояла химическая, или гидратная, теория растворов Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем. В преодолении кажущегося противоречия обеих теорий большая заслуга принадлежит русскому ученому И. А. Каблукову, впервые высказавшему предположение о гидратации ионов. Развитие этой идеи привело в дальнейшем к объединению теорий Аррениуса и Менделеева.
| <<< Назад 81. Особенности растворов солей, кислот и оснований. |
Вперед >>> 83. Процесс диссоциации. |
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
