Книга: Общая химия
50. Внутреннее строение кристаллов.
| <<< Назад 49. Кристаллическое состояние вещества. |
Вперед >>> 51. Реальные кристаллы. |
50. Внутреннее строение кристаллов.
Давно предполагали, что внешняя форма кристалла отражает его внутреннее строение и обусловлена правильным расположением частиц, составляющих кристалл, — молекул, атомов или ионов.
Это расположение можно представить в виде кристаллической решетки — пространственного каркаса, образованного пересекающимися прямыми линиями. В точках пересечения линий — узлах решетки - лежат центры частиц.
Исследовать внутреннюю структуру кристаллов удалось в XX веке, после того, как в 1912 г. была открыта дифракция рентгеновских лучей, на которой основан рентгеноструктурный анализ.
При падении пучка монохроматических (т. е. одинаковых по длине волны) рентгеновских лучей на грань кристалла большая часть пучка проходит через кристалл, но некоторая его доля претерпевает отражение. Это отражение происходит от плоскостей, образованных частицами, составляющими кристаллическую решетку данного вещества. Такие плоскости играют роль штрихов дифракционной решетки; расстояния между ними близки к длинам волн рентгеновских лучей, поэтому последние, отражаясь от параллельных плоскостей, интерферируют друг с другом. При определенных углах падения пучка лучей на грань кристалла наблюдается усиление отраженного луча, которое регистрируется на фотопленке — получается рентгенограмма данного кристалла. Расшифровка ее, при известной длине волны применяемого излучения, приводит к определению расстояний между соседними плоскостями или, что то же самое, между соседними атомами (ионами) в кристалле данного вещества.
Рентгеноструктурный анализ служит основным методом изучения строения твердых тел. В некоторых случаях используют дифракцию электронов (электронографический анализ), а также нейтронов. В настоящее время методами рентгеноструктурного анализа изучено строение десятков тысяч неорганических и органических веществ, имеющих практическое и научное значение. Большие успехи достигнуты в расшифровке структур биологически важных веществ (например, гемоглобина). Благодаря применению методов рентгеноструктурного анализа устанавливается молекулярное строение наследственного вещества живых организмов.
В зависимости от природы частиц, находящихся в узлах кристаллической решетки, и от того, какие силы взаимодействия между ними преобладают в данном кристалле, различают молекулярные, атомные, ионные и металлические решетки.
В узлах молекулярных решеток находятся молекулы. Они связаны друг с другом межмолекулярными силами. В узлах атомных решеток находятся атомы; они связаны друг с другом ковалентной связью. В узлах ионных решеток располагаются, чередуясь, положительно и отрицательно заряженные ионы. Они связаны друг с другом силами электростатического притяжения. Наконец, в узлах металлических решеток находятся атомы металла, между которыми свободно движутся общие для этих атомов электроны. Металлические решетки рассматриваются в гл. XVI.
Молекулярные и атомные решетки присущи веществам с ковалентной связью, ионные — ионным соединениям, металлические — металлам и их сплавам.
Веществ, обладающих атомными решетками, сравнительно мало. К ним принадлежат алмаз, кремний и некоторые неорганические соединения. Эти вещества характеризуются высокой твердостью, они тугоплавки и нерастворимы практически ни в каких растворителях. Такие их свойства обусловлены прочностью ковалентной связи.
Веществ с молекулярной решеткой очень много. К ним принадлежат неметаллы, за исключением углерода и кремния, все органические соединения с неионной связью и многие неорганические вещества. Силы межмолекулярного взаимодействия значительно слабее сил ковалентной связи, поэтому молекулярные кристаллы имеют небольшую твердость, легкоплавки и летучи.
К соединениям с ионной связью, образующим ионные решетки, относится большинство солей и небольшое число оксидов. По прочности ионные решетки уступают атомным, но превышают молекулярные. Ионные соединения имеют сравнительно высокие температуры плавления; летучесть их в большинстве случаев невелика.
Существуют вещества, в кристаллах которых значительную роль играют два рода взаимодействия между частицами. Так, в графите атомы углерода связаны друг с другом в одних направлениях ковалентной связью, а в других — металлической. Поэтому решетку графита можно рассматривать и как атомную, и как металлическую. Во многих неорганических соединениях, например, в BeO, ZnS, CuCl, связь между частицами, находящимися в узлах решетки, является частично ионной и частично ковалентной; решетки подобных соединений можно рассматривать как промежуточные между ионными и атомными.
Решетки различных веществ различаются между собой не только по природе образующих их частиц, но и по взаимному расположению частиц в пространстве — по своему строению. Каждую решетку можно охарактеризовать ее элементарной ячейкой— наименьшей частью кристалла, имеющей все особенности структуры данной решетки (см. рис. 61). Как видно, в кристалле NaCl каждый ион окружен шестью ближайшими ионами противоположного знака, а в кристалле CsCl — восемью. Это число ближайших частиц для той или иной частицы в кристалле называется ее координационным числом. Таким образом, координационное число иона Na+ и иона Cl- в кристалле NaCl равно 6, а ионов Cs+ и Cl- в кристаллах CsCl равно 8.
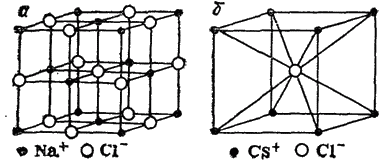
Рис. 61. Кристаллические решетки хлорида натрия (а) и хлорида цезия (б).
- 155 -
В кристаллах обеих этих солей, а также других ионных соединений все связи каждого иона с ближайшими ионами противоположного знака равноценны. Отсюда следует, что понятие о молекуле неприменимо к кристаллическим веществам с ионной связью. Также неприменимо это понятие и к кристаллам с атомной или смешанной атомно-ионной структурой. В таких веществах, как алмаз, карборунд SiC, имеющих атомную решетку, или как ZnS, Al2O3 обладающих промежуточной атомно-ионной структурой, все связи каждого атома с ближайшими соседними атомами равноценны.
| <<< Назад 49. Кристаллическое состояние вещества. |
Вперед >>> 51. Реальные кристаллы. |
- § 9. Строение и эволюция Вселенной
- 7. СТРОЕНИЕ И ОСОБЕННОСТИ ЖИЗНЕДЕЯТЕЛЬНОСТИ ЖИВЫХ ОРГАНИЗМОВ
- Построение профиля рельефа по карте
- § 1. Строение и состав Солнечной системы. Две группы планет
- Строение ВТМ
- § 52. Растения, их строение. Вегетативные органы
- § 44. Строение клетки
- 3. ВНУТРЕННЕЕ СТРОЕНИЕ И РЕЛЬЕФ ЗЕМЛИ
- § 30. Состав и строение атмосферы
- 2. Строение клеточной стенки и цитоплазматической мембраны
- Природа России РЕЛЬЕФ. Геологическое Строение и Полезные Ископаемые
- § 16. Внутреннее строение Земли
