Книга: Общая химия
21. Ядерная модель атома.
| <<< Назад 20. Радиоактивность. |
Вперед >>> 23. Квантовая теория света. |
21. Ядерная модель атома.
Изучение радиоактивности подтвердило сложность состава атомов. Встал вопрос о строении атома, о его внутренней структуре.
Согласно модели, предложенной в 1903 г. Дж. Дж. Томсоном, атом состоит из положительного заряда, равномерно распределенного по всему объему атома, и электронов колеблющихся внутри этого заряда. Для проверки гипотезы Томсона и более точного определения внутреннего строения атома Э. Резерфорд провел серию опытов по рассеянию ?-частиц тонкими металлическими пластинками. Схема такого опыта изображена на рис. 2. Источник ? — излучения И помещали в свинцовый кубик К с просверленным в нем каналом, так что удавалось получить поток ?-частиц, летящих в определенном направлении.
- 58 -
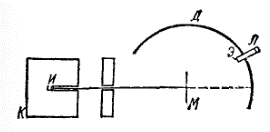
Рис. 2. Схема опыта по рассеянию ?-частиц.
Попадая на экран Э, покрытый сульфидом цинка, ?-частицы вызывали его свечение, причем в лупу Л можно было увидеть и подсчитать отдельные вспышки, возникающие на экране при попадании на него каждой ?-частицы. Между источником излучения и экраном помещали тонкую металлическую фольгу М. По вспышкам на экране можно было судить о рассеянии ?-частиц, т.е. об их отклонении от первоначального направления при прохождении через слой металла.
Оказалось, что большинство ?-частиц проходит через фольгу, не изменяя своего направления, хотя толщина металлического листочка соответствовала сотням тысяч атомных диаметров. Но некоторая доля ?-частиц все же отклонялась на небольшие углы, а изредка ?-частицы резко изменяли направление своего движения и даже отбрасывались назад, как бы натолкнувшись на массивное препятствие. Случаи такого резкого отклонения ?-частиц можно было наблюдать, перемещая экран с лупой по дуге Д.
Из результатов этих опытов следовало, что подавляющая часть пространства, занимаемого атомом металла, не содержит тяжелых частиц — там могут находиться только электроны. Ведь масса электрона почти в 7500 раз меньше массы ?-частицы, так что столкновение с электроном практически не может повлиять на направление движения ?-частицы. Случаи же резкого отклонения и даже отбрасывания ?-частиц означают, что в атоме есть какое-то тяжелое ядро, в котором сосредоточена преобладающая часть всей массы атома. Это ядро занимает очень маленький объем — именно поэтому ?-частицы так редко с ним сталкиваются — и должно обладать положительным зарядом, который и вызывает отталкивание одноименно заряженных ?-частиц.
Исходя из этих соображений, Резерфорд в 1911 г. предложил следующую схему строения атома, получившую название ядерной модели атома. Атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него электронов. Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом вследствие вращения электронов центробежная сила уравновешивается силой электростатического притяжения электронов к противоположно заряженному ядру. Размеры ядра очень малы по сравнению с размерами атома в целом: диаметр атома — величина порядка 10-8 см, а диаметр ядра — порядка 10-13 — 10-12 см.
Чем больше заряд атомного ядра, тем сильнее будет отталкиваться от него ?-частица, тем чаще будут встречаться случаи сильных отклонений ?-частиц, проходящих через слой металла, от первоначального направления движения.
- 59 -
Поэтому опыты по рассеянию ?-частиц дают возможность не только обнаружить существование атомного ядра, но и определить его заряд. Уже из опытов Резерфорда следовало, что заряд ядра (выраженный в единицах заряда электрона) численно равен порядковому номеру элемента в периодической системе. Это было подтверждено Г. Мозли, установившим в 1913 г. простую связь между длинами волн определенных линий рентгеновского спектра элемента и его порядковым номером, и Д. Чедвиком, с большой точностью определившим в 1920 г. заряды атомных ядер ряда элементов по рассеянию ?-частиц.
Был установлен физический смысл порядкового номера элемента в периодической системе: порядковый номер оказался важнейшей константой элемента, выражающей положительный заряд ядра его атома. Из электронейтральности атома следует, что и число вращающихся вокруг ядра электронов равно порядковому номеру элемента.
Это открытие дало новое обоснование расположению элементов в периодической системе. Вместе с тем оно устраняло и кажущееся противоречие в системе Менделеева — положение некоторых элементов с большей атомной массой впереди элементов с меньшей атомной массой (теллур и йод, аргон и калий, кобальт и никель). Оказалось, что противоречия здесь нет, так как место элемента в системе определяется зарядом атомного ядра. Было экспериментально установлено, что заряд ядра атома теллура равен 52, а атома йода — 53; поэтому теллур, несмотря на большую атомную массу, должен стоять до йода. Точно так же заряды ядер аргона и калия, никеля и кобальта полностью отвечают последовательности расположения этих элементов в системе.
Итак, заряд атомного ядра является той основной величиной. От которой зависят свойства элемента и его положение в периодической системе. Поэтому периодический закон Менделеева в настоящее время можно сформулировать следующим образом:
Свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов.
Определение порядковых номеров элементов по зарядам ядер их атомов позволило установить общее число мест в периодической системе между водородом, имеющим порядковый номер 1, и ураном (порядковый номер 92), считавшимся в то время последним членом периодической системы элементов. Когда создавалась теория строения атома, оставались незанятыми места 43, 61, 72, 75, 85 и 87, что указывало на возможность существования еще не открытых элементов. И действительно, в 1922 г. был открыт элемент гафний, который занял место 72; затем в 1925 г. - рений, занявший место 75. Элементы, которые должны занять остальные четыре свободных места таблицы, оказались радиоактивными и в природе не найдены, однако их удалось получить искусственным путем.
- 60 -
Новые элементы получили названия технеций (порядковый номер 43), прометий (61), астат (85) и франций (87). В настоящее время все клетки периодической системы между водородом и ураном заполнены. Однако сама периодическая система не является завершенной, о чем свидетельствует открытие трансурановых (заурановых) элементов (подробнее см. § 37).
22. Атомные спектры.
Развитая Резерфордом ядерная модель была крупным шагом в познании строения атома. Основные черты этой модели — наличие в атоме положительно заряженного тяжелого ядра, окруженного электронами — выдержали испытание временем и подтверждены большим числом экспериментов. Однако модель Резерфорда в некоторых отношениях противоречила твердо установленным фактам. Отметим два таких противоречия.
Во-первых, теория Резерфорда не могла объяснить устойчивости атома. Электрон, вращающийся вокруг положительно заряженного ядра, должен, подобно колеблющемуся электрическому заряду, испускать электромагнитную энергию в виде световых волн. Но, излучая свет, электрон теряет часть своей энергии, что приводит к нарушению равновесия между центробежной силой, связанной с вращением электрона, и силой электростатического притяжения электрона к ядру. Для восстановления равновесия электрон, должен переместиться ближе к ядру. Таким образом, электрон должен непрерывно излучая электромагнитную энергию и двигаясь по спирали, будет приближаться к ядру. Исчерпав всю свою энергию, он должен «упасть» на ядро, - и атом прекратит свое существование. Этот вывод противоречит реальным свойствам атомов, которые представляют собой устойчивые образования и могут существовать, не разрушаясь, чрезвычайно долго.
Во-вторых, модель Резерфорда приводила к неправильным выводам о характере атомных спектров. Напомним, что при пропускании через стеклянную или кварцевую призму света, испускаемого раскаленным твердым или жидким телом, на экране, поставленном за призмой, наблюдается так называемый сплошной спектр, видимая часть которого представляет собой цветную полосу, содержащую все цвета радуги*. Это явление объясняется тем, что излучение раскаленного твердого или жидкого тела состоит из электромагнитных волн всевозможных частот. Волны различной частоты неодинаково преломляются призмой и попадают на разные места экрана.
* Спектр простирается и за пределы частот, соответствующих видимому свету, - в ультрафиолетовую (более высокие частоты) и инфракрасную (более низкие частоты) области.
Для получения спектра вместо призмы можно воспользоваться дифракционной решеткой.
- 61 -
Последняя представляет собой стеклянную пластинку, на поверхности которой на очень близком расстоянии друг от друга нанесены тонкие параллельные штрихи (до 1500 штрихов на 1 мм). Проходя сквозь такую решетку, свет разлагается и образует спектр, аналогичный полученному при помощи призмы, дифракция присуща всякому волновому движению и служит одним из основных доказательств волновой природы света.
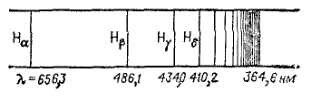
Рис 3. Схема атомного спектра водорода в видимой области.
(На рисунке указаны принятые обозначения отдельных линий и длины волн).
Излучение, испускаемое твердыми телами или жидкостями, всегда дает сплошной спектр. Излучение, испускаемое раскаленными газами и парами, в отличие от излучения твердых тел и жидкостей, содержит только определенные длины волн. Поэтому вместо сплошной полосы на экране получается ряд отдельных цветных линий, разделенных темными промежутками. Число и расположение этих линий зависят от природы раскаленного газа или пара. Так, парЫ калия дают спектр, состоящий из трех линий — двух красных и одной фиолетовой; в спектре паров кальция несколько красных, желтых и зеленых линий и т.д. Такие спектры называются линейчатыми. На рис 3 приведено в качестве примера изображение атомного спектра водорода в видимой и близкой ультрафиолетовой области. Тот факт, что атомы каждого элемента дают вполне определенный, присущий только этому элементу спектр, причем интенсивность соответствующих спектральных линий тем выше, чем больше содержание элемента во взятой пробе, широко применяется для определения качественного и количественного состава веществ и материалов. Этот метод исследования называется спектральным анализом.
Как было указано выше, электрон, вращающийся вокруг ядра, должен приближаться к ядру, непрерывно меняя скорость своего движения. Частота испускаемого им света определяется частотой его вращения и, следовательно, должна непрерывно меняться. Это означает, что спектр излучения атома должен быть непрерывным, сплошным, а это не соответствует действительности. Таким образом, теория Резерфорда не смогла объяснить ни существования устойчивых атомов, ни наличия у них линейчатых спектров.
Существенный шаг в развитии представлений о строении атома сделал в 1913 г. Нильс Бор, предложивший теорию, объединяющую ядерную модель атома с квантовой теорией света.
| <<< Назад 20. Радиоактивность. |
Вперед >>> 23. Квантовая теория света. |
- 20. Радиоактивность.
- 21. Ядерная модель атома.
- 23. Квантовая теория света.
- 24. Строение электронной оболочки атома по Бору.
- 25. Исходные представления квантовой механики.
- 26. Волновая функция.
- 27. Энергетическое состояние электрона в атоме.
- 28. Главное квантовое число.
- 29. Орбитальное квантовое число. Формы электронных облаков.
- 30. Магнитное и спиновое квантовые числа.
- 31. Много электронные атомы.
- 32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
- 33. Размеры атомов и ионов.
- 34. Энергия ионизации и сродство к электрону.
- 35. Строение атомных ядер. Изотопы.
- 36. Радиоактивные элементы и их распад.
- 37. Искусственная радиоактивность. Ядерные реакции.
