Книга: Общая химия
ПОДГРУППА ХРОМА
| <<< Назад 227. Ниобий (Niobium). Тантал (Tantalum). |
Вперед >>> 229. Молибден (Mollbdenium). |
Разделы на этой странице:
ПОДГРУППА ХРОМА
Подгруппу хрома образуют металлы побочной подгруппы шестой группы — хром, молибден и вольфрам.
Наружный электронный слой атомов элементов подгруппы хрома содержит один или два электрона, что обусловливает металлический характер этих элементов и их отличие от элементой главной подгруппы. Вместе с тем их максимальная степень окисленности равна +6, так как, помимо наружных электронов, в образовании связей может участвовать еще соответствующее число электронов из недостроенного предпоследнего слоя.
Для хрома и его аналогов наиболее типичны производные высшей степени окисленности, во многом сходные с соответствующими соединениями серы. 228. Хром (Chromium).
Хром содержится в земной коре в количестве 0,02% (масс.). В природе он встречается главным образом в виде хромистого железняка FeO·Cr2O3, богатые месторождения которого имеются в Казахстане и на Урале.
При восстановлении хромистого железняка углем получается сплав хрома с железом — феррохром, который непосредственно используется в металлургической промышленности при производстве хромистых сталей. Для получения чистого хрома сначала получают оксид хрома(III), а затем восстанавливают его алюмино-термическим способом.
- 634 -
Хром представляет собой твердый блестящий металл, плавящийся при 1890°C плотность его 7,19 г/см3. При комнатной температуре хром стоек и к воде и к воздуху. Разбавленные серная и соляная кислоты растворяют хром с выделением водорода. В холодной концентрированной азотной кислоте хром нерастворим и после обработки ею становится пассивным.
Металлический хром используется для хромирования, а также в качестве одного из важнейших компонентов легированных сталей. Введение хрома в сталь повышает ее устойчивость против коррозии как в водных средах при обычных температурах, так и в газах при повышенных температурах. Кроме того, хромистые стали обладают повышенной твердостью. Хром входит в состав нержавеющих кислотоупорных, жаропрочных сталей (см. также стр. 537, 665).
Хром образует три оксида: оксид хрома(II), или закись хрома, CrO, имеющий основной характер, оксид хрома (III), или окись хрома, Cr2O3, проявляющий амфотерные свойства, и оксид хрома (VI), или хромовый ангидрид, CrO3 — кислотный оксид. Соответственно этим трем оксидам известны и три ряда соединений хрома.
Соединения хрома(II).
При растворении хрома в соляной кислоте получается раствор голубого цвета, содержащий хлорид CrCl2. Если к этому раствору прилить щелочи, то выпадает желтый осадок — гидроксид хрома(II) Cr(OH)2. Соединения хрома (II) неустойчивы и быстро окисляются кислородом воздуха в соединения хрома (III).
Соединения хрома(III).
Оксид хрома(III) Cr2O3 представляет собой тугоплавкое вещество зеленого цвета, применяемое род названием зеленого крона для приготовления клеевой и масляной красок. При сплавлении с силикатами оксид хрома (III) окрашивает их в зеленый цвет и поэтому служит для окраски стекла и фарфора, Cr2O3 входит также в состав полирующих средств.
Гидроксид хрома(III) Cr(OH)3 выпадает в виде синевато-серого осадка при действии щелочей на соли хрома(III):
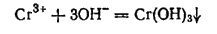
Подобно гидроксидам алюминия и цинка, он имеет амфотерный характер и растворяется в кислотах с образованием солей хрома (III), а в щелочах — с образованием изумрудно-зеленых растворов хромитов, например:
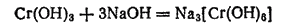
или
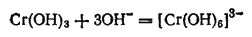
Хромиты, полученные сплавлением Cr2O3 с оксидами других металлов и известные главным образом для двухвалентных металлов, имеют состав, отвечающий формуле M(CrO2)2, и представляют собой соли метахромистой кислоты HCrO2.
- 635 -
К ним относится и природный хромистый железняк Fe(CrO2O)2.
Из солей хрома(III) самой распространенной является двойная соль хрома и калия — хромокалиевые квасцы KCr(SO4)2·12H2O, образующие сине-фиолетовые кристаллы. Хромокалиевые квасцы применяются в кожевенной промышленности для дубления кож и в текстильной промышленности в качестве протравы при крашении.
Соли хрома(III) во многом похожи на соли алюминия. В водных растворах они сильно гидролизованы и легко превращаются в основные соли. Со слабыми кислотами хром(III), подобно алюминию, солей не образует.
Растворы солей хрома (III) обычно имеют сине-фиолетовый цвет, но при нагревании становятся зелеными, а спустя некоторое время после охлаждения снова приобретают прежнюю окраску. Это изменение окраски объясняется образованием изомерных гидратов солей, представляющих собой комплексные соединения, в которых все или часть молекул воды координационно связаны во внутренней сфере комплекса. В некоторых случаях такие гидраты удалось выделить в твердом виде. Так, кристаллогидрат хлорида хрома (III) CrCl3·6H2O известен в трех изомерных формах: в виде сине-фиолетовых, темнозеленых и светло-зеленых кристаллов одинакового состава. Строение этих изомеров можно установить на основании различного отношения их свежеприготовленных растворов к нитрату серебра. При действии последнего на раствор сине-фиолетового гидрата осаждается весь хлор; из раствора темнозеленого гидрата осаждается 2/3 хлора, а из раствора светло-зеленого гидрата — только 1/3 хлора. Принимая во внимание эти данные, а также координационное число хрома, равное шести, строение рассматриваемых кристаллогидратов можно выразить следующими формулами:
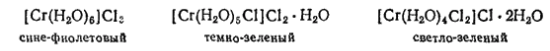
сине-фиолетовый темно-зеленый светло-зеленый
Таким образом, изомерия гидратов хлорида хрома (III) обусловлена различным распределением одних и тех же групп (H2O и Cl-) между внутренней и внешней координационными сферами и может служить примером гидратной изомерии (стр. 574).
Соединения хрома(VI).
Важнейшими соединениями хрома (VI) являются триоксид хрома, или хромовый ангидрид, CrO3 и соли отвечающих ему кислот — хромовой H2CrO4 и двухромовой H2Cr2O7. Обе кислоты существуют только в водном растворе и при попытках выделить их из раствора распадаются на хромовый ангидрид и воду; но соли их достаточно стойки. Соли хромовой кислоты называются хроматами, а двухромовой — бихроматами или дихроматами.
Почти все хроматы имеют желтую окраску. Некоторые из них применяются в качестве красок. Например, нерастворимый в воде хромат свинца PbCrO4, под названием желтый крон, служит для приготовления желтой масляной краски.
При подкислении раствора какого-нибудь хромата, например хромата калия K2CrO4, чисто-желтая окраска раствора сменяется на оранжевую вследствие перехода ионов CrO42- в ионы Cr2O72-.
- 636 -
Из полученного раствора может быть выделена соль двухромовой кислоты — дихромат калия K2Cr2O7 — в виде оранжево-красных кристаллов. Реакция превращения хромата в дихромат выражается уравнением:
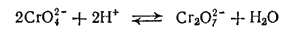
Реакция обратима. Это значит, что при растворении дихромата в воде всегда образуется некоторое, хотя и незначительное, количество ионов H+ и CrO42- поэтому раствор дихромата имеет кислую реакцию. Если к раствору дихромата прибавлять щелочь, то гидроксид-ионы будут связывать находящиеся в растворе ионы водорода, равновесие смещается влево и в результате дихромат превращается в хромат. Таким образом, в присутствии избытка гидроксид-ионов в растворе практически существуют только ионы CrO42-, т. е. хромат, а при избытке ионов водорода — ионы Cr2O72-, т. е. дихромат.
Хроматы щелочных металлов получаются путем окисления соединений хрома(III) в присутствии щелочи. Так, при действии брома на раствор хромита калия образуется хромат калия:
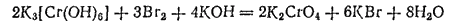
О происходящем окислении можно судить по тому, что изумрудно-зеленая окраска раствора хромита переходит в ярко-желтую.
Хроматы могут быть получены также сплавлением Cr2O3 со щелочью в присутствии какого-нибудь окислителя, например хлората калия:
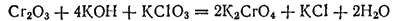
Хроматы и дихроматы — сильные окислители. Поэтому ими широко пользуются для окисления различных веществ. Окисление производится в кислом растворе и обычно сопровождается резким изменением окраски (дихроматы окрашены в оранжевый цвет, а соли хрома(III) зеленый или зеленовато-фиолетовый).
Мы видели, что в кислых и в щелочных растворах соединения хрома (III) и хрома (VI) существуют в разных формах: в кислой среде в виде ионов Cr3+ или Cr2O72-, а в щелочной — в виде ионов [Cr(OH)6]3- или CrO42-. Поэтому взаимопревращение соединений хрома (III) и хрома (VI) протекает по-разному в зависимости от реакции раствора. В кислой среде устанавливается равновесие
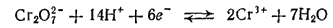
а в щелочной
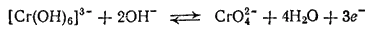
Однако и в кислой, и в щелочной среде окисление хрома (III) приводит к уменьшению pH раствора; обратный же процесс — восстановление хрома(VI) - сопровождается увеличением pH.
- 637 -
Поэтому, в соответствии с принципом Ле Шателье, при повышении кислотности среды равновесие смещается в направлении восстановления хрома (VI), а при уменьшении кислотности — в направлении окисления хрома (III). Иначе говоря, окислительные свойства соединений хрома (VI) наиболее сильно выражены в кислой среде, а восстановительные свойства соединений хрома(III) - в щелочной. Именно поэтому, как указывалось выше, окисление хромитов в хроматы осуществляют в присутствии щелочи, а соединения хрома (VI) применяют в качестве окислителей в кислых растворах.
Приведем несколько примеров окислительно-восстановительных реакций, протекающих при участии дихроматов.
1. При пропускании сероводорода через подкисленный серной кислотой раствор дихромата оранжевая окраска раствора переходит в зеленую и одновременно жидкость становится мутной вследствие выделения серы:

2. При действии концентрированной соляной кислоты на дихромат калия выделяется хлор и получается зеленый раствор, содержащий хлорид хрома (III):

3. Если пропускать диоксид серы через концентрированный раствор дихромата калия, содержащий достаточное количество серной кислоты, то образуются эквимолекулярные количества сульфатов калия и хрома (III):
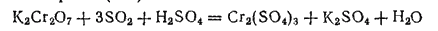
При выпаривании раствора из него выделяются хромокалиевые квасцы KCr(S)4)2·12H2O. Этой реакцией пользуются для получения хромокалиевых квасцов в промышленности.
Наиболее важными из дихроматов являются дихромат калия K2Cr2O7 и дихромат натрия Na2Cr2O7·2H2O, образующие оранжево-красные кристаллы. Обе соли, известные также под названием хромпиков, широко применяются в качестве окислителей при производстве многих органических соединений, в кожевенной промышленности при дублении кож, в спичечной и текстильной промышленности. Смесь концентрированной серной кислоты с водным раствором дихромата калия или натрия под названием «хромовой смеси» часто применяется для энергичного окисления и для очистки химической посуды.
Все соли хромовых кислот ядовиты.
Триоксид хрома, или хромовый ангидрид, CrO3 выпадает в виде темно-красных игольчатых кристаллов при действии концентрированной серной кислоты на насыщенный раствор дихромата калия или натрия:
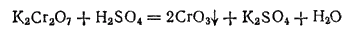
- 638 -
Хромовый ангидрид принадлежит к числу наиболее сильных окислителей. Например, этиловый спирт при соприкосновении с ним воспламеняется. Производя окисление, хромовый ангидрид превращается в оксид хрома (III) Cr2O3.
Хромовый ангидрид легко растворяется в воде с образованием хромовой и двухромовой кислот.
| <<< Назад 227. Ниобий (Niobium). Тантал (Tantalum). |
Вперед >>> 229. Молибден (Mollbdenium). |
- Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
- Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- ПОДГРУППА МАРГАНЦА
- Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
- ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
- ПОДГРУППА ВАНАДИЯ
- ПОДГРУППА ТИТАНА
- 220. Подгруппа скандия.
- Колонки нейронов и сознание
- Современная классификация бактерий
