Книга: Общая химия
201. Серебро (Argentum).
| <<< Назад 200. Медь. (Cuprum). |
Вперед >>> 202. Золото (Aurum). |
201. Серебро (Argentum).
Серебро распространено в природе значительно меньше, чем медь; содержание его в земной коре составляет всего 10-5 (масс). В некоторых местах (например, в Канаде) серебро встречается в самородном состоянии, но большую часть серебра получают из его соединений. Самой важной серебряной рудой является серебряный блеск, или аргентит, Ag2S.
В качестве примеси серебро присутствует почти во всех медных и особенно свинцовых рудах. Из этих руд и получают около 80% всего добываемого серебра.
В СССР серебро получают главным образом из серебряно-свинцовых руд, месторождения которых имеются на Урале, Алтае, Северном Кавказе, в Казахстане.
Чистое серебро — очень мягкий, тягучий металл, оно лучше всех металлов проводит теплоту и электрический ток.
На практике чистое серебро вследствие мягкости почти не применяется: обычно его сплавляют с большим или меньшим количеством меди.
- 559 -
Сплавы серебра служат для изготовления ювелирных и бытовых изделий, монет, лабораторной посуды*. Серебро используется для покрытия им других металлов, а также радиодеталей в целях повышения их электрической проводимости и устойчивости к коррозии. Часть добываемого серебра расходуется на изготовление серебряно-цинковых аккумуляторов.
В серебряно-цинковых аккумуляторах, обладающих хорошими электрическими характеристиками и имеющих малую массу и объем, электродами служат оксиды серебра Ag2O, AgO (катод) и губчатый цинк (анод); электролитом служит раствор КОН.
При работе аккумулятора цинк окисляется, превращаясь в ZnO и Zn(OH)2, а оксид серебра восстанавливается до металла. Суммарную реакцию, протекающую при разряде аккумулятора, можно приближенно выразить уравнением:
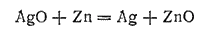
Э. д. с. заряженного серебряно-цинкового аккумулятора приближенно равна 1,85 В. При снижении напряжения до 1,25 В аккумулятор заряжают. При этом процессы электродах «обращаются»: цинк восстанавливается, серебро окисляется — вновь получаются вещества, необходимые для работы аккумулятора.
Серебро — малоактивный металл. В атмосфере воздуха оно не окисляется ни при комнатных температурах, ни при нагревании. Часто наблюдаемое почернение серебряных предметов — результат образования на их поверхности черного сульфида серебра Ag2S. Это происходит под влиянием содержащегося в воздухе сероводорода (см. стр. 371), а также при соприкосновении серебряных предметов с пищевыми продуктами, содержащими соединения серы.
В ряду напряжений серебро расположено значительно дальше водорода. Поэтому соляная и разбавленная серная кислоты на него не действуют. Растворяют серебро обычно в азотной кислоте, которая взаимодействует с ним согласно уравнению:
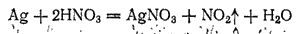
Серебро образует один ряд солей, растворы которых содержат бесцветные катионы Ag+.
Оксид серебра(I), или закись серебра, Ag2O. При действии щелочей на растворы солей серебра можно ожидать получения AgOH, но вместо него выпадает бурый осадок оксида серебра(I):
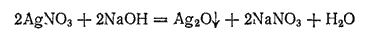
Оксид серебра (I) незначительно растворяется в воде (0,017 г/л), Получающийся раствор имеет щелочную реакцию и, подобий щелочам, осаждает гидроксиды некоторых металлов из растворов их солей. Очевидно, в растворе содержится гидроксид серебра AgOH, представляющий собой довольно сильное основание.
* Содержание серебра или золота в сплаве указывает проба, которая ставится на изделии в виде клейма. В Советском Союзе применяется метрическая система проб. Метрическая проба показывает, сколько единиц массы драгоценного металла содержится в 1000 единицах массы сплава. наиболее распространены изделия из серебра 800 и 875 пробы, из золота - 583 и 750
- 560 -
Последнее подтверждается тем, что соли серебра не гидролизуются.
Кроме оксида серебра(I) известны оксиды AgO и Ag2O3.
Наибольшее значение имеют следующие соли серебра.
Нитрат серебра AgNO3, называемый также ляписом. Образует бесцветные прозрачные кристаллы, хорошо растворимые в воде. Применяется в производстве фотоматериалов, при изготовлении зеркал, в гальванотехнике, в медицине.
Хлорид серебра AgCl образуется в виде белого творожистого нерастворимого в воде и кислотах осадка при взаимодействии ионов серебра с хлорид-ионами. На свету хлорид серебра постепенно темнеет, разлагаясь с выделением металлического серебра. Такими же свойствами обладают бромид и иодид серебра, имеющие в отличие от хлорида серебра желтоватый цвет. Напротив, фторид серебра AgF растворим в воде.
Комплексные соединения серебра. Подобно меди, серебро обладает склонностью к образованию комплексных соединений.
Многие нерастворимые в воде соединения серебра, например оксид серебра(I) и хлорид серебра, легко растворяются в водном растворе аммиака. Причина растворения заключается в образовании комплексных ионов [Ag(NH3)2]+. Например, равновесия, устанавливающиеся при взаимодействии хлорида серебра с водным раствором аммиака, можно представить следующей схемой:
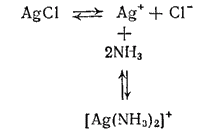
В насыщенном растворе хлорида серебра устанавливается динамическое равновесие между ионами Ag+ и Cl- и осадком AgCl. Вводимые в раствор молекулы аммиака связываются с ионами серебра в комплексные ионы [Ag(NH3)2]+ и осадок растворяется. Таким образом, в аммиачном растворе серебро находится в виде комплексных катионов [Ag(NH3)2]+. Но наряду с ними в растворе всегда остается и некоторое, хотя и незначительное количество ионов серебра вследствие диссоциации комплексного иона согласно уравнению:
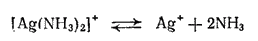
Комплексные цианистые соединения серебра применяются для гальванического серебрения, так как при электролизе растворов этих солей на поверхности изделий осаждается плотный слой мелкокристаллического серебра.
- 561 -
При пропускании тока через раствор K[Ag(CN)2] серебро выделяется на катоде за счет незначительного количества ионов серебра, которое получается вследствие диссоциации комплексного аниона:
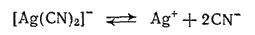
Все соединения серебра легко восстанавливаются с выделением металлического серебра. Если к аммиачному раствору оксида серебра(I), находящемуся в стеклянном сосуде, прибавить в качестве восстановителя немного глюкозы или формалина, то металлическое серебро выделяется в виде плотного блестящего зеркального слоя на поверхности стекла. Этим способом готовят зеркала, а также серебрят внутреннюю поверхность стекла в сосудах Дьюара и в термосах для уменьшения потери теплоты лучеиспусканием.
Соли серебра, особенно хлорид и бромид, ввиду их способности разлагаться под влиянием света с выделением металлического серебра, широко используются для изготовления фотоматериалов — пленки, бумаги, пластинок. Фотоматериалы обычно представляют собой светочувствительную суспензию AgBr в желатине, слой которой нанесен на целлулоид, бумагу или стекло.
При экспозиции в тех местах светочувствительного слоя, где на него попал свет, образуются мельчайшие зародыши кристаллов металлического серебра. Это — скрытое изображение фотографируемого предмета. При проявлении бромид серебра разлагается, причем скорость разложения тем больше, чем выше концентрация зародышей в данном месте слоя. Получается видимое изображение, которое является обращенным, или негативны и, изображением, поскольку степень почернения в каждом месте светочувствительного слоя тем больше, чем выше была его освещенность при экспозиции. В ходе закрепления (фиксирования) из светочувствительного слоя удаляется неразложившийся бромид серебра. Это происходит в результате взаимодействия между AgBr и веществом закрепителя — тиосульфатом натрия. При этой реакции получается растворимая комплексная соль:
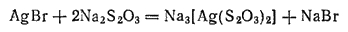
Далее негатив накладывают на фотобумагу и подвергают действию света — «печатают». При этом наиболее освещенными оказываются те места фотобумаги, которые находятся против светлых мест негатива. Поэтому в ходе печатания соотношение между светом и тенью меняется на обратное и становится отвечающим сфотографированному объекту. Это — позитивное изображение.
Ионы серебра подавляют развитие бактерий и уже в очень низкой концентрации (около 10-10 моль/л) стерилизуют питьевую воду. В медицине для дезинфекции слизистых оболочек применяются стабилизированные специальными добавками коллоидные растворы серебра (протаргол, колларгол и др.).
| <<< Назад 200. Медь. (Cuprum). |
Вперед >>> 202. Золото (Aurum). |
