Книга: Общая химия
200. Медь. (Cuprum).
| <<< Назад 199. Калий (Kalium). |
Вперед >>> 201. Серебро (Argentum). |
Разделы на этой странице:
200. Медь. (Cuprum).
Общее содержание меди в земной коре сравнительно невелико [0,01% (масс.)], однако она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины. Этим, а также сравнительной легкостью обработки меди объясняется то, что она ранее других металлов была использована человеком.
В настоящее время медь добывают из руд. Последние, в зависимости от характера входящих в их состав соединений, подразделяют на оксидные и сульфидные. Сульфидные руды имеют наибольшее значение, поскольку из них выплавляется 80 % всей добываемой меди.
Важнейшими минералами, входящими в состав медных руд, являются: халькозин, или медный блеск, Cu2S; халькопирит, или медный колчедан, CuFeS2; малахит (CuOH)2CO3.
- 553 -
В СССР богатые месторождения медных руд находятся на Урале, в Казахстане и в Закавказье.
Медные руды, как правило, содержат большое количество пустой породы, так что непосредственное получение из них меди экономически невыгодно. Поэтому в металлургии меди особенно важную роль играет обогащение (обычно флотационный метод), позволяющее использовать ряды с небольшим содержанием меди.
Выплавка меди из ее сульфидных руд или концентратов представляет собою сложный процесс. Обычно он слагается из следующих операций: обжиг, плавка, конвертирование, огневое и электролитическое рафинирование. В ходе обжига большая часть сульфидов примесных элементов превращается в оксиды. Так, главная примесь большинства медных руд пирит FeS2 превращается в Fe2O3. Газы, отходящие при обжиге, содержат SO2 и используются для получения серной кислоты.
Получающиеся в ходе обжига оксиды железа, цинка и других примесей отделяются в виде шлака при плавке. Основной же продукт плавки — жидкий штейн (Cu2S с примесью FeS) поступает в конвертор, где через пего продувают воздух. В ходе конвертирования выделяется диоксид серы и получается черновая, или сырая, медь.
Для извлечения ценных спутников ( Au, Ag, Te и др.) и для удаления вредных примесей черновая медь подвергается огневому, а затем электролитическому рафинированию. В ходе огневого рафинирования жидкая медь насыщается кислородом. При этом примеси железа, цинка, кобальта окисляются, переходят в шлак и удаляются. Медь же разливают в формы. Получающиеся отливки служат анодами при электролитическом рафинировании (см. § 103).
Чистая медь — тягучий вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на ее поверхности тончайшая пленка оксидов (придающая меди более темный цвет) служит хорошей защитой от дальнейшего окисления. Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (CuOH)2CO3. При нагревании на воздухе в интервале температур 200-375°C медь окисляется до черного оксида меди (II) CuO. При более высоких температурах на ее поверхности образуется двухслойная окалина: поверхностный слой представляет собой оксид меди (II), а внутренний — красный оксид меди (I). Ввиду высокой теплопроводности, электрической проводимости, ковкости, хороших литейных качеств, большого сопротивления на разрыв и химической стойкости медь широко используется в промышленности.
Большие количества чистой электролитической меди (около 40% всей добываемой меди) идут на изготовление электрических проводов и кабелей. Из меди изготовляют различную промышленную аппаратуру: котлы, перегонные кубы и т. п.
Широкое применение в машиностроительной промышленности, а также в электротехнике и других производствах имеют различные сплавы меди с другими металлами. Важнейшими из них являются латуни (сплавы меди с цинком), медноникелевые сплавы и бронзы.
- 554 -
Латуни содержат до 45% цинка. Различают простые и специальные латуни. В состав последних, кроме меди и цинка, входят другие элементы, например железо, алюминий, олово, кремний. Латуни находят разнообразное применение. Из них изготовляют трубы для конденсаторов и радиаторов, детали механизмов, в частности часовых. Некоторые специальные латуни обладают высокой коррозионной стойкостью в морской воде и применяются в судостроении. Латунь с высоким содержанием меди — томпак — благодаря своему внешнему сходству с золотом используется для ювелирных и декоративных изделий.
Медноникелевые сплавы подразделяются на конструкционные и электротехнические. К конструкционным относятся мельхиоры и нейзильберы. Мельхиоры содержат 20-30% никеля и небольшие количества железа и марганца, а нейзильберы 5-35% никеля и 13-45% цинка. Благодаря стойкости против коррозии в воде, в том числе в морской, конструкционные медноникелевые сплавы получили широкое распространение в судостроении и в энергетической промышленности. Из них изготовляют радиаторы, трубопроводы, дистилляционные установки для получения питьевой воды из морской. К электротехническим медноникелевым сплавам относятся константан (40% Ni, 1.5% Mn) и манганин (3% Ni, 12% Mn), обладающие низким температурным коэффициентом электросопротивления и служащие для изготовления магазинов сопротивления, а также копель (43% Ni, 0.5% Mn), применяемый для изготовления термопар.
Бронзы подразделяются по основному входящему в их состав компоненту (кроме меди) на оловянные, алюминиевые, кремнистые и др. Из них оловянные представляют собой самые древние сплавы. На протяжении столетий они занимали ведущее место во многих отраслях производства. Сейчас применение их в машиностроении сокращается. Более широко применяются алюминиевые бронзы (5-10% Al и добавки Fe, Mn, Ni). Бериллиевые бронзы очень прочны и применяются для изготовления пружин и других ответственных деталей.
Все медные сплавы обладают высокой стойкостью против атмосферной коррозии.
В химическом отношении медь является малоактивным металлом. Однако с галогенами она реагирует уже при комнатной температуре, например, с влажным мором образует хлорид CuCl2. О взаимодействии меди с кислородом воздуха говорилось выше, При нагревании медь взаимодействует и с серой, образуя сульфид Cu2S.
Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислоты на медь не действуют.
- 555 -
Однако в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соответствующих солей:
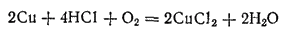
Летучие соединения меди окрашивают несветящее пламя газовой горелки в сине-зеленый цвет.
Известны соединения, в которых медь имеет степень окисленности один, два и три. Их можно рассматривать как производные соответствующих оксидов: Cu2O, CuO и Cu2O3.
Соединения меди(I), в общем, менее устойчивы, чем соединения меди(II). Оксид Cu2O3 и его производные весьма нестойки.
Соединения меди(I).
Оксид меди(I), или закись меди, Cu2O встречается в природе в виде минерала куприта. Искусственно она может быть получена путем нагревания раствора соли меди(II) со щелочью и каким-нибудь сильным восстановителем, например формалином или глюкозой. При нагревании образуется осадок красного оксида меди(I).
В паре с металлической медью Cu2O применяется в купроксных выпрямителях переменного тока.
При действии на Cu2O соляной кислоты получается бесцветный раствор хлорида меди(I) CuCl. Если разбавить этот раствор водой, то хлорид меди(I) выпадает в виде белого творожистого осадка, нерастворимого в воде. Он может быть получен также кипячением раствора хлорида меди (II) CuCl2 с металлической медью в солянокислой среде:
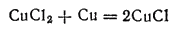
Соединения меди(II).
Оксид меди(II), или окись меди, CuO — черное вещество, встречающееся в природе (например, в виде минерала тенорита). Его можно легко получить прокаливанием карбоната гидроксомеди(II) (CuOH)2CO3 или нитрата меди(II) Cu(NO3)2. Оксид меди(II) проявляет окислительные свойства. При нагревании с различными органическими веществами CuO окисляет их, превращая углерод в диоксид углерода, а водород — в воду и восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе органических веществ для определения содержания в них углерода и водорода.
Гидроксид меди(II) Cu(OH)2 осаждается из растворов солей меди(II) в виде голубой студенистой массы при действии щелочей. Уже при слабом нагревании даже под водой он разлагается, превращаясь в черный оксид меди(II).
Гидроксид меди(II) Cu(OH)2 - очень слабое основание. Поэтому растворы солей меди(II) в большинстве случаев имеют кислую реакцию, а со слабыми кислотами медь образует основные соли.
Важнейшими из солей меди(II) являются следующие.
Сульфат меди(II) CuSO4 в безводном состоянии представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях. Водный раствор сульфата меди имеет характерный сине-голубой цвет.
- 556 -
Эта окраска свойственна гидратированным ионам [Cu(H2O)4]2+, поэтому такую же окраску имеют все разбавленные растворы солей меди(II), если только они не содержат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы. В таком виде он называется медным купоросом (см. стр. 376).
Хлорид меди(II) CuCl2·2H2O. Образует темно-зеленые кристаллы, легко растворимые в воде. Очень концентрированные растворы хлорида меди(II) имеют зеленый цвет, разбавленные — сине-голубой.
Нитрат меди(II) Cu(NO3)2·3H2O. Получается при растворении меди в азотной кислоте. При нагревании синие кристаллы нитрата меди сначала теряют воду, а затем легко разлагаются с выделением кислорода и бурого диоксида азота, переходя в оксид меди(II).
Карбонат гидроксомеди(II) (CuOH)2CO3. Встречается в природе в виде минерала малахита, имеющего красивый изумруднозеленый цвет. Искусственно приготовляется действием Na2CO3 на растворы солей меди(II):
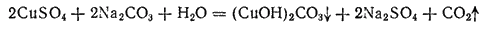
Применяется для получения хлорида меди(II), для приготовления синих и зеленых минеральных красок, а также в пиротехнике.
Ацетат меди(II) Cu(CH3COO)2·2H2O. Получается обработкой металлической меди или оксида меди(II) уксусной кислотой. Обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски.
Смешанный ацетат-арсенит меди(II) Cu(CH3COO)2·Cu3(AsO3)2. Применяется под названием париэюская зелень для уничтожения вредителей растений.
Из солей меди вырабатывают большое количество минеральных красок, разнообразных по цвету: зеленых, синих, коричневых, фиолетовых и черных. Все соли меди ядовиты, поэтому медную посуду лудят, т. е. покрывают внутри слоем олова, чтобы предотвратить возможность образования медных солей.
Комплексные соединения меди. Характерное свойство двухзарядных ионов меди — их способность соединяться с молекулами аммиака с образованием комплексных ионов.
Если к раствору сульфата меди приливать раствор аммиака, то выпадает голубой осадок основной соли, который легко растворяется в избытке аммиака, окрашивая жидкость в интенсивный синий цвет. Прибавление щелочи к полученному раствору не вызывает образования осадка гидроксида меди Cu(OH)2 следовательно, в этом растворе так мало ионов Cu2+, что даже при большом количестве ионов ОН- не достигается произведение растворимости Cu(OH)2.
- 557 -
Отсюда можно заключить, что ионы меди вступают во взаимодействие с прибавленным аммиаком и образуют какие-то новые ионы, которые не дают нерастворимого соединения с ионами ОН-. В то же время ионы SO42- остаются неизмененными, так как прибавление к аммиачному раствору хлорида бария тотчас же вызывает образование осадка сульфата бария (характерная реакция на SO42-).
Исследованиями установлено, что темно-синяя окраска аммиачного раствора обусловлена присутствием в нем сложных ионов [Cu(NH3)4]2+, образовавшихся путем присоединения к иону меди четырех молекул аммиака. При испарении воды ионы [Cu(NH3)4]2+ связываются с ионами SO42- и из раствора выделяются темносиние кристаллы, состав которых выражается формулой [Cu(NH3)4]SO4·H2O.
Таким образом, при взаимодействии сульфата меди(II) с аммиаком происходит реакция
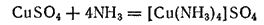
или в ионной форме:
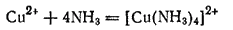
Ионы, которые, подобно [Cu(NH3)4]2+, образуются путем присоединения к данному иону нейтральных молекул или ионов противоположного знака, называются комплексными ионами. Соли, в состав которых входят такие ионы, получили название комплексных солей. Известны также комплексные кислоты, комплексные основания и комплексные неэлектролиты.
При написании формул комплексный ион обычно заключают в квадратные скобки. Этим отмечается, что при растворении данного соединения в воде комплексный ион практически не диссоциирует.
Подобно сульфату меди(II) реагируют с аммиаком и другие соли двухвалентной меди. Во всех этих случаях получаются темносиние растворы, содержащие комплексные ионы [Cu(NH3)4]2+.
Гидроксид меди(II) тоже растворяется в аммиаке с образованием темно-синего раствора, содержащего ионы [Cu(NH3)4]2+:
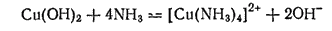
Получающийся раствор обладает способностью растворять целлюлозу (вату, фильтровальную бумагу и т. п.) и применяется при изготовлении одного из видов искусственного волокна (см. стр. 480).
Гидроксид меди (II) растворяется также в очень концентрированных растворах щелочей, образуя сине-фиолетовые растворы купритов - солей, содержащих комплексный ион [Cu(OH)4]2-
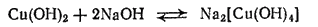
- 558 -
или в ионной форме:
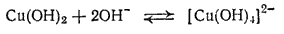
В отличие от аммиачных комплексов меди, в этом случае ион меди присоединяет к себе не нейтральные молекулы, а ионы OH-, вследствие чего образуются комплексные анионы, а не катионы. Куприты очень нестойки и при разбавлении щелочных растворов водой разлагаются, выделяя гидроксид меди(II) в осадок.
Из других комплексных анионов меди (II) отметим ионы [CuCl4]2-, образующиеся в концентрированных растворах хлорида меди(II) и обусловливающие их зеленую окраску:
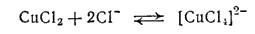
При разбавлении растворов водой ионы [CuCl4]2- превращаются в обычные гидратированные ионы меди [Cu(H2O)4]2+ и зеленая окраска растворов переходит в сине-голубую:
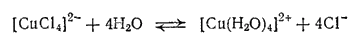
Медь принадлежит к числу микроэлементов. Такое название получили Fe, Cu, Mn, Mo, B, Zn, Co в связи с тем, что малые количества их необходимы для нормальной жизнедеятельности растений. Микроэлементы повышают активность ферментов, способствуют синтезу сахара, крахмала, белков, нуклеиновых кислот, витаминов и ферментов. Микроэлементы вносят в почву с микроудобрениями. Удобрения, содержащие медь, способствуют росту растений на некоторых малоплодородных почвах, повышают их устойчивость против засухи, холода и некоторых заболеваний.
| <<< Назад 199. Калий (Kalium). |
Вперед >>> 201. Серебро (Argentum). |
