Книга: Общая химия
139. Гидразин. Гидроксиламин. Азидоводород.
| <<< Назад 138. Фиксация атмосферного азота. Получение аммиака. |
Вперед >>> 140. Оксиды азота. |
139. Гидразин. Гидроксиламин. Азидоводород.
Кроме аммиака, азот образует еще несколько соединений с водородом, не имеющих, однако, такого значения, как аммиак. Важнейшие из них следующие.
Гидразин N2H4 — бесцветная жидкость, кипящая при 113,5°C, получается при действии гипохлорита натрия NaClO на концентрированный раствор аммиака.
Структурная формула гидразина:
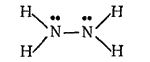
В молекуле гидразина атомы азота имеют неподеленные пары электронов. Это обусловливает способность гидразина к реакциям присоединения. Гидразин хорошо растворяется в воде, а при взаимодействии с кислотами присоединяет по донорно-акцепторному способу один или два иона водорода, образуя два ряда солей — например хлориды гидразоиня N2H4·HCl и N2H4·2HCl. Таким образом, гидразин обладает основными свойствами.
Гидразин — хороший восстановитель. При его горении в атмосфере воздуха или кислорода выделяется очень большое количество теплоты, вследствие чего гидразин нашел применение в качестве составной части топлива ракетных двигателей. Гидрозин и все его производные сильно ядовиты.
- 394 -
Гидроксиламин NH2OH — бесцветные кристаллы (темп. плавл. около 33°C). Его структурная формула:
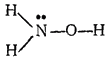
В молекуле гидрокснламнна атом азота имеет неподелспную пару электронов. Поэтому, подобно аммиаку и гидразину, он способен к реакциям присоединения с образованием связен по доиорно-акцепторному способу. Гидроксиламин хорошо растворяется в воде, а с кислотами дает соли, например хлорид гидроксиламмония (NH3OH)Cl. Степень окислениости азота в гидроксила мине равна —1. Поэтому он проявляет как восстановительные, так и окислительные свойства. Однако более характерна восстановительная способность гидроксиламина. В частности, он применяется как восстановитель (главным образом в виде солей) в лабораторной практике. Кроме того, его используют в производстве некоторых органических веществ.
Азидоводород, или азотистоводородная кислота, HN3 может быть получен действием азотистой кислоты HNO2 на водный раствор гидразина; он представляет собой бесцветную жидкость (темп. кип. 36°C) с резким запахом.
Азидоводород принадлежит к числу слабых кислот (K=3·10-5). В водном растворе он диссоциирует на ионы H+ и N3- . Анион азидоводорода N3 имеет линейное строение. Его электронную структуру можно выразить схемой:

Как сам азидоводород, так и его соли — азиды — очень взрывчаты. Азид свинца Pb(N3)2 применяется для снаряжения капсюлей-детонаторов.
| <<< Назад 138. Фиксация атмосферного азота. Получение аммиака. |
Вперед >>> 140. Оксиды азота. |
- АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- 138. Фиксация атмосферного азота. Получение аммиака.
- 140. Оксиды азота.
- Функции белков
- 906. Какие отходы сбрасываются в океан в наибольших количествах?
- Агрессивное поведение и гормоны
- Крохотные ученики
- § 50 Адаптации организмов к условиям обитания как результат действия естественного отбора
- 57. В каких районах Антарктики США ведут океанографические исследования?
- Гаур (Bos gaurus)
- 966. Что представляет собой стандарт на питьевую воду в США?
- 9.29. СУРИК
- Почвоведение в XX в.
