Книга: Общая химия
АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота.
| <<< Назад Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ |
Вперед >>> 137. Аммиак. Соли аммония. |
АЗОТ (NITROGENIUM)*
136. Азот в природе. Получение и свойства азота.
Большая часть азота находится в природе в свободном состоянии. Свободный азот является главной составной частью воздуха, который содержит 78,2% (об.) азота. Неорганические соединения азота не встречаются в природе в больших количествах, если не считать натриевую селитру NaNO3, образующую мощные пласты на побережье Тихого океана в Чили. Почва содержит незначительные количества азота, преимущественно в виде солей азотной кислоты. Но в виде сложных органических соединений — белков — азот входит в состав всех живых организмов. Превращения, которым подвергаются белки в клетках растений и животных, составляют основу всех жизненных процессов. Без белка нет жизни, а так как азот является обязательной составной частью белка, то понятно, какую важную роль играет этот элемент в живой природе.
Общее содержание азота в земной коре (включая гидросферу и атмосферу) составляет 0,04 (масс.).
* Название "азот" происходит от греческого слова "азоос", что значит безжизненный. Латинское название азота - nitrogenium - буквально означает "рождающий селитру"
- 385 -
Получение азота из воздуха сводится в основном к отделению его от кислорода. В промышленности это осуществляется путем испарения жидкого воздуха в специальных установках.
В лабораториях обычно пользуются азотом, поставляемым в баллонах под повышенным давлением или в сосудах Дьюара. Можно получать азот разложением некоторых его соединений, например нитрита аммония NH4NO2, который разлагается с выделением азота при сравнительно небольшом нагревании:
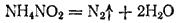
В молекуле азота N2 атомы связаны тройной связью. Энергия диссоциации этой молекулы очень велика (945 кДж/моль), поэтому термическая диссоциация азота делается заметной лишь при очень сильном нагревании (при 3000°C диссоциирует около 0.1%).
Азот — бесцветный газ, не имеющий запаха и весьма мало растворимый в воде. Он немного легче воздуха: масса 1 л азота равна 1,25 г.
Молекулярный азот — химически малоактивное вещество. При комнатной температуре он взаимодействует лишь с литием. Малая активность азота объясняется большой прочностью его молекул, обусловливающей высокую энергию активации реакций, протекающих с участием азота. Однако при нагревании он начинает реагировать со многими металлами — с магнием, кальцием, титаном. С водородом азот вступает во взаимодействие при высоких температуре и давлении в присутствии катализатора. Реакция азота с кислородом начинается при 3000-4000°C.
Животные, помещенные в атмосферу азота, быстро погибают, но не вследствие ядовитости азота, а из-за отсутствия кислорода.
Основное применение азот находит в качестве исходного продукта для синтеза аммиака и некоторых других соединений. Кроме того, он применяется для заполнения электрических ламп, для создания инертной среды при промышленном проведении некоторых химических реакций, при перекачке горючих жидкостей.
| <<< Назад Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ |
Вперед >>> 137. Аммиак. Соли аммония. |
- АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- Получение и использование синтетических полимеров
- Глава 7 Получение нуклеотидов из продуктов атмосферной фотохимии
- Получение нуклеотидов
- Глава 21 По ту сторону физики Получение знания, имеющего смысл, но неизмеримого экспериментально…
- Получение кристаллов с определенными свойствами
- Получение кристаллов с заданным химическим составом
- Получение кристаллов заданной формы
- Получение крупногабаритных кристаллов
- 8.35. ПОЛУЧЕНИЕ ФЕНОЛА — НЕЛЕГКАЯ ЗАДАЧА
- 143. Промышленное получение азотной кислоты.
- 197. Щелочные металлы в природе. Получение и свойства щелочных металлов.
- 131. Получение и применение серной кислоты.
