Книга: Общая химия
119. Химические свойства галогенов.
| <<< Назад 118. Галогены в природе. Физические свойства галогенов. |
Вперед >>> 120. Получение и применение галогенов. |
119. Химические свойства галогенов.
Свободные галогены проявляют чрезвычайно высокую химическую активность. Они вступают во взаимодействие почти со всеми простыми веществами. Особенно быстро и с выделением большого количества теплоты протекают реакции соединения галогенов с металлами. Так, расплавленный металлический натрий в атмосфере хлора сгорает с ослепительной вспышкой, а на стенках сосуда появляется белый налет хлорида натрия:
2Na + Cl2 = 2NaCl
Медь, железо, олово и многие другие металлы сгорают в хлоре, образуя соответствующие соли. Подобным же образом взаимодействуют с металлами бром и иод. Во всех этих случаях атомы металла отдают электроны, т. е. окисляются, а атомы галогенов присоединяют электроны, т. е. восстанавливаются. Эта способность присоединять электроны, резко выраженная у атомов галогенов, является их характерным химическим свойством. Следовательно, галогены — очень энергичные окислители.
Окислительные свойства галогенов проявляются также и при взаимодействии их со сложными веществами. Приведем несколько примеров.
1. При пропускании хлора через раствор хлорида железа (II) последний окисляется в хлорид железа (III), вследствие чего раствор из бледно-зеленого становится желтым:
2FeCl2 +Cl2 = 2FeCl3
2. Если к желтоватому водному раствору иода добавить сероводородной воды (водный раствор H2S ), то жидкость обесцвечивается и становится мутной от выделившейся серы:
- 343 -
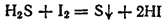
3. При действии водного раствора брома на раствор сульфита натрия Na2SO3 происходит обесцвечивание раствора, так как бром окисляет сульфит до сульфата натрия, а сам восстанавливается, превращаясь в бесцветный бромоводород. Реакция протекает при участии молекул воды и выражается уравнением
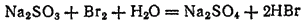
или в ионно-молекулярной форме:
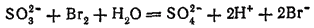
Химическая активность фтора исключительно высока. По образному выражению академика А. Е. Ферсмана, его можно назвать «всесъедающим». Щелочные металлы, свинец, железо загораются в атмосфере фтора при комнатной температуре. На некоторые металлы (Cu, Ni) фтор на холоду не действует, так как на их поверхности образуется защитный слой фторида. Однако при нагревании фтор реагирует со всеми металлами, в том числе с золотом и платиной.
Со многими неметаллами (водород, иод, бром, сера, фосфор, мышьяк, сурьма, углерод, кремний, бор) фтор взаимодействует на холоду; реакции протекают со взрывом или с образованием пламени:

При нагревании с фтором соединяются хлор, криптон и ксенон, например:
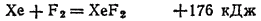
Непосредственно фтор не реагирует только с кислородом, азотом и углеродом (в виде алмаза).
Очень энергично протекает взаимодействие фтора со сложными веществами. В его атмосфере горят такие устойчивые вещества, как стекло (в виде ваты) и водяной пар:
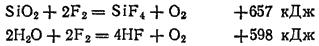
Интересно отметить, что при этом в качестве одного из продуктов горения образуется кислород.
Свободный хлор тоже проявляет очень высокую химическую активность, хотя и меньшую, чем фтор. Он непосредственно взаимодействует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Такие неметаллы, как фосфор, мышьяк, сурьма и кремний, уже при низкой температуре реагируют с хлором; при этом выделяется большое количество теплоты.
Энергично протекает взаимодействие хлора с активными металлами — натрием, калием, магнием и др.
При комнатной температуре без освещения хлор практически не взаимодействует с водородом, но при нагревании или на ярком солнечном свету реакция протекает по цепному механизму (см. § 62) со взрывом.
Химическая активность брома и иода меньше, чем хлора, но все же велика. Со многими металлами и неметаллами (например, с фосфором) они реагируют в обычных условиях. При этом бром по активности мало уступает хлору, а иод отличается от хлора значительно.
Взаимодействие брома с водородом происходит лишь при нагревании. Иод с водородом реагирует только при достаточно сильном нагревании и не полностью, так как начинает идти обратная реакция — разложение иодоводорода:
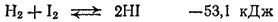
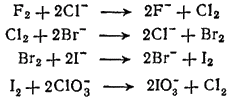
Сравнение химических свойств галогенов показывает, что их окислительная активность последовательно уменьшается от фтора к астату. Этот эффект проявляется в способности более легких галогенов в виде простых веществ окислять галогенид - ионы более тяжелых галогенов и в способности более тяжелых галогенов восстанавливать кислородные соединения более легких галогенов:
Несмотря на меньшую энергию сродства к электрону у фтора, чем у хлора (см. табл. 23), фтор является все же самым сильным окислителем среди галогенов. Объясняется это следующим. Превращение газообразного хлора или фтора в отрицательно заряженные ионы можно рассматривать как состоящее из двух стадий — диссоциации молекул на отдельные атомы
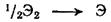
и присоединения электрона к образовавшемуся свободному атому галогена:
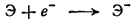
Первая стадия процесса требует затраты энергии на разрыв связей между атомами галогена в молекуле; мерой этих энергетических затрат может служить энтальпия диссоциации молекул галогена. У хлора, состоящего из более прочных молекул, энтальпия диссоциации в расчете на 1 моль атомов галогена (121,5 кДж/моль) значительно выше, чем у фтора (79,5 кДж/моль).
Вторая стадия процесса сопровождается выделением энергии (сродство к электрону); здесь выигрыш энергии в случае хлора (348,7 кДж/моль) несколько выше, чем в случае фтора (332,7 кДж/моль).
- 345 -
Как нетрудно подсчитать, общий выигрыш энергии в рассматриваемом процессе для фтора (253,2 кДж/моль) выше, чем для хлора (227,2 кДж/моль), что и характеризует фтор как более сильный окислитель.
Если реакция протекает в водном растворе, то следует учесть и энергию гидратации галогенид-ионов; при одинаковом заряде нона она тем выше, чем меньше радиус иона. Следовательно, при гидратации фторид-иона F- выделяется больше энергии, чем при гидратации иона Cl-, так что и в водных растворах фтор будет более сильным окислителем, чем хлор.
Аналогичные расчеты показывают, что при переходе от хлора к брому и иоду выигрыш энергии в окислительных процессах, протекающих в водных растворах с участием галогенов; также уменьшается. Этим и объясняется способность каждого галогена вытеснять более тяжелые галогены, находящиеся в степени окисленности —1, из растворов их соединений.
| <<< Назад 118. Галогены в природе. Физические свойства галогенов. |
Вперед >>> 120. Получение и применение галогенов. |
- 118. Галогены в природе. Физические свойства галогенов.
- 121. Соединения галогенов с водородом.
- Химические элементы и вещества
- § 50 Химические реакции
- 427. Какие химические элементы содержатся в морской воде в наибольших количествах?
- Глава 8 Биогенная миграция химических элементов и биогеохимические принципы
- 682. Как химические питательные вещества преобразуются в пищу?
- 8.2. Биогеохимические принципы
- 909. Каковы основные химические загрязнители?
- 429. Как различные химические элементы попали в морскую воду?
- § 14. Химические явления. Горение
- 182. Каковы важнейшие физико-химические свойства воды?
