Книга: Общая химия
107. Коллоиды и коллоидные растворы.
| <<< Назад 106. Состояние вещества на границе раздела фаз. |
Вперед >>> 108. Дисперсионный анализ. |
107. Коллоиды и коллоидные растворы.
Частицы коллоидных размеров могут иметь различную внутреннюю структуру, что существенно сказывается как на методах получения коллоидных растворов, так и на их свойствах. Существуют следующие три типа внутренней структуры первичных частиц коллоидных размеров.
I тип — суспензоиды (или необратимые коллоиды, лиофобные коллоиды). Так называют коллоидные растворы металлов, их оксидов, гидроксидов, сульфидов и других солей. Первичные частицы дисперсной фазы коллоидных растворов этих веществ по своей внутренней структуре не отличаются от структуры соответствующего компактного вещества и имеют молекулярную или ионную кристаллическую решетку. Суспензоиды — типичные гетерогенные высокодисперсные системы, свойства которых определяются очень сильно развитой межфазной поверхностью. От суспензий они отличаются более высокой дисперсностью. Суспензоидами их назвали потому, что, как и суспензии, они не могут длительно существовать в отсутствие стабилизатора дисперсности. Необратимыми их называют потому, что осадки, остающиеся при выпаривании таких коллоидных растворов, не образуют вновь золя при контакте с дисперсионной средой. Лиофобными (греч. "лиос" — жидкость, «фобио» — ненавижу) их назвали, предполагая, что особые свойства коллоидных растворов этого типа обусловлены очень слабым взаимодействием дисперсной фазы и дисперсионной среды. Концентрация лиофобных золей невелика, обычно меньше 0.1%. Вязкость таких золей незначительно отличается от вязкости дисперсионной среды.
Лиофобные золи, как вообще дисперсные системы, в соответствии с их промежуточным положением между миром молекул и крупных тел, могут быть получены двумя путями: методами диспергирования, т. е. измельчения крупных тел, и методами конденсации молекулярно - или ионнорастворенных веществ. Измельчение путем дробления, помола, истирания дает сравнительно крупно-дисперсные порошки (<60 мкм).
- 303 -
Более тонкого измельчения достигают с помощью специальных аппаратов, получивших название коллоидных мельниц, или применяя ультразвук.
Метод конденсации состоит в получении нерастворимых соединений путем реакций обмена, гидролиза, восстановления, окисления. Проводя эти реакции в сильно разбавленных растворах и в присутствии небольшого избытка одного из компонентов, получают не осадки, а коллоидные растворы. К конденсационным методам относится также получение лиозолей путем замены растворителя. Например, коллоидный раствор канифоли можно получить, выливая ее спиртовой раствор в воду, в которой канифоль нерастворима.
Как было выяснено ранее (§ 106), чем выше дисперсность, тем больше свободная поверхностная энергия, тем больше склонность к самопроизвольному уменьшению дисперсности. Поэтому для получения устойчивых, т. е. длительно сохраняющихся, суспензий, эмульсий, коллоидных растворов необходимо не только достигнуть заданной дисперсности, но и создать условия для ее стабилизации. Ввиду этого устойчивые дисперсные системы состоят не менее чем из трех компонентов: дисперсионной среды, дисперсной фазы и третьего компонента — стабилизатора дисперсной системы.
Стабилизатор может иметь как ионную, так и молекулярную, часто высокомолекулярную, природу. Ионная стабилизация золей лиофобных коллоидов связана с присутствием малых концентраций электролитов, создающих ионные пограничные слои между дисперсной фазой и дисперсионной средой (см. § 112 и 113).
Высокомолекулярные соединения (белки, полипептиды, поливиниловый спирт и другие), добавляемые для стабилизации дисперсных систем, называют защитными коллоидами. Адсорбируясь на границе раздела фаз, они образуют в поверхностном слое сетчатые и гелеобразные структуры, создающие структурно-механический барьер, который препятствует объединению частиц дисперсной фазы. Структурно-механическая стабилизация имеет решающее значение для стабилизации взвесей, паст, пен, концентрированных эмульсий.
II тип — ассоциативные, или мицеллярные, коллоиды. Их называют также полуколлоидами. Коллоиднодисперсные частицы этого типа возникают при достаточной концентрация дифильных* молекул низкомолекулярных веществ путем их ассоциации в агрегаты молекул — мицеллы — сферической или пластинчатой формы (рис. 90):
* Дифильными называют молекулы, которые состоят из углеводородного радикала, имеющего сродство к неполярным растворителям, и гидрофильной (полярной) группы, имеющий сродство к воде.
- 304 -
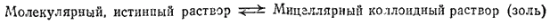
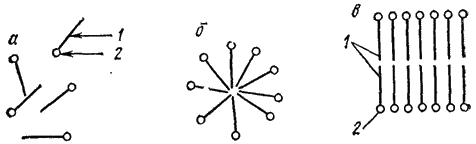
Рис. 90. Растворы мицеллярных коллоидов; молекулярный раствор (а), коллоидные раствори со сферическими (б) и пластинчатыми (в) мицеллами. Дифильная молекула: 1 — углеводородный радикал; 2 — полярная (-OOH, -OH, NH2) группа.
Мицеллы представляют собой скопления правильно расположенных молекул, удерживаемых преимущественно дисперсионными силами.
Образование мицелл характерно для водных растворов моющих веществ (например, мыл — щелочных солей высших жирных кислот) и некоторых органических красителей с большими молекулами. В других средах, например в этиловом спирте, эти вещества растворяются с образованием молекулярных растворов.
III тип — молекулярные коллоиды. Их называют также обратимыми или лиофильными (от греч. "филио" - люблю) коллоидами. К ним относятся природные и синтетические высокомолекулярные вещества с молекулярной массой от десяти тысяч до нескольких миллионов. Молекулы этих веществ имеют размеры коллоидных частиц, поэтому такие молекулы называют макромолекулами.
Разбавленные растворы высокомолекулярных соединений — это истинные, гомогенные растворы, которые при предельном разведении подчиняются общим законам разбавленных растворов. Растворы высокомолекулярных соединений могут быть приготовлены также с высоким содержанием по массе — до десяти и более процентов. Однако молярная концентрация таких растворов мала из-за большой молекулярной массы растворенного вещества. Так, 10 %-ный раствор вещества с молекулярной массой 100 000 представляет собой лишь примерно 0,0011 М раствор.
Для получения растворов молекулярных коллоидов достаточно привести сухое вещество в контакт с подходящим растворителем. Неполярные макромолекулы растворяются в углеводородах (например, каучуки — в бензоле), а полярные макромолекулы — в полярных растворителях (например, некоторые белки — в воде и водных растворах солей). Вещества этого типа назвали обратимыми коллоидами потому, что после выпаривания их растворов и добавления новой порции растворителя сухой остаток вновь переходит в раствор.
- 305 -
Название лиофнльные коллоиды возникло из предположения (как оказалось — ошибочного), что сильное взаимодействие со средой обусловливает их отличие от лиофобных коллоидов.
Растворение макромолекулярных коллоидов проходящих через стадию набухания, являющуюся характерной качественной особенностью веществ этого типа. При набухании молекулы растворителя проникают в твердый полимер и раздвигают макромолекулы. Последние из-за своего большого размера медленно диффундируют в раствор, что внешне проявляется в увеличении объема полимера. Набухание может быть неограниченным, когда конечным его результатом является переход полимера в раствор, и ограниченным, если набухание не доходит до растворения полимера. Ограниченно набухают обычно полимеры с особой, «трехмерной» структурой, отличающейся тем, что атомы всего вещества соединены валентными связями. Химическая модификация полимеров путем «сшивания» их макромолекул с целью уменьшения набухания полимера является важной стадией в производстве многих материалов (дубление сыромятной кожи, вулканизация каучука при превращении его в резину).
Растворы высокомолекулярных соединений имеют значительную вязкость, которая быстро возрастает с увеличением концентрации растворов. Повышение концентрации макромолекулярных растворов, добавки веществ, понижающих растворимость полимера, и часто понижение температуры приводят к застудневанию, т. е. превращению сильно вязкого, но текучего раствора в сохраняющий форму твердообразный студень. Растворы полимеров с сильно вытянутыми макромолекулами застудневают при небольшой концентрации раствора. Так, желатин и агар-агар образуют студии и гели в 0.2-0.1% растворах. Высушенные студни способны вновь набухать (существенное отличие от гелей).
Застудневание является важной стадией получения волокнистых материалов из растворов полимеров. Свойства растворов высокомолекулярных соединений с повышением их концентрации все больше и больше отличаются от свойств растворов низкомолекулярных соединений. Это происходит в результате взаимодействия друг с другом отдельных макромолекул, приводящего к образованию надмолекулярных структур, оказывающих большое влияние на качества изделий (волокон, пластмасс) из полимеров.
Высокомолекулярные соединения, как и любые другие вещества, при подходящих условиях могут быть получены в высокодисперсном — коллоидном состоянии. Такие дисперсии полимеров в нерастворяющих их жидкостях, большей частью в воде, называют латексами. Частицы дисперсной фазы латексов имеют близкую к сферической форму и размеры порядка 10—100 нм.
Термин «коллоиды», что означает «клееподобные» (от греч. «колла» — клей, «еидос» — вид), возник в 1861 г., когда шотландский химик Томас Грэм для разделения веществ применил диализ (рис. 91). Метод диализа основан на неодинаковой способности компонентов растворов к диффузии через тонкие пленки - мембраны (из целлофана, пергамента, нитроцеллюлозы, ацетилцеллюлозы).
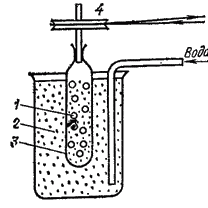
Рис. 91. Схема диализа: 1 - внутренний диализируемый раствор; 2 — наружная жидкость; 3 — диализационная мембрана (через ее поры проходят только низкомолекулярные вещества); 4 — шкив для вращения мембраны с внутренним раствором.
- 306 -
Этот метод широко применяют для очистки коллоидных растворов и растворов высокомолекулярных соединений. Вещества, не проникающие через мембраны при диализе, Грэм назвал коллоидами, а вещества, способные к диализу, - кристаллоидами, так как при выпаривании их растворов образовывались кристаллические осадки.
Деление веществ на кристаллоиды и коллоиды оказалось ошибочным. П. П. Веймарн, доцент Петербургского горного института, получил ряд типичных «кристаллоидов» в коллоидном состоянии, тем самым доказав (1906 г.), что любое вещество при подходящих условиях может быть получено в коллоидном состоянии.
В 30-40-х годах XX века была выяснена химическая природа первичных частиц обратимых (лиофильных) коллоидов, оказавшихся макромолекулами. В связи с этим от коллоидной химии отделилась новая химическая дисциплина — физическая химия высокомолекулярных соединений. Однако в силу исторических причин, общности молекулярно-кинетических свойств лиофильных и лиофобных коллоидов, частого образования гетерогенных структур в молекулярных коллоидах, а также существования многочисленных композиций из высокомолекулярных соединений и высокоднсперсных систем (например, резины, многие лакокрасочные материалы, стеклопластики, пено- и поропласты) предмет коллоидной химии трактуют более расширенно, чем сказано в § 106, а именно, как физическую химию гетерогенного дисперсного состояния вещества, межфазовых поверхностей и высокомолекулярных соединений.
| <<< Назад 106. Состояние вещества на границе раздела фаз. |
Вперед >>> 108. Дисперсионный анализ. |
- 105. Дисперсное состояние вещества.
- 106. Состояние вещества на границе раздела фаз.
- 107. Коллоиды и коллоидные растворы.
- 108. Дисперсионный анализ.
- 109. Сорбция и сорбционные процессы.
- 110. Ионообменная адсорбция.
- 111. Хроматография.
- 112. Электрокинетические явления.
- 113. Устойчивость и коагуляция дисперсных систем.
- 114. Структурообразование в дисперсных системах.
