Книга: Общая химия
105. Дисперсное состояние вещества.
| <<< Назад Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ |
Вперед >>> 106. Состояние вещества на границе раздела фаз. |
105. Дисперсное состояние вещества.
Дисперсные системы. Кристаллы любого вещества, например сахара или хлорида натрия, можно получить разного размера — крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру — молекулярную или ионную кристаллическую решетку.
При растворении в воде кристаллов сахара и хлорида натрия образуются соответственно молекулярные и ионные растворы. Таким образом, одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2-0,1 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2-0,1 мм до 400-300 нм, разрешающая способность микроскопа при освещении белым светом) и отдельные молекулы (или ионы).
- 296 -
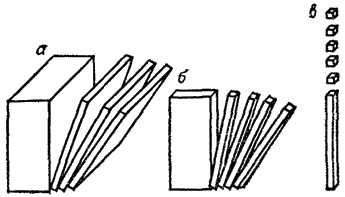
Рис. 87. Одно-, двух- и трехмерное диспергирование вещества приводит к образованию пленочно-(а), волокнисто-(б) и корпускулярнодисперсных (в) систем.
Постепенно складывались представления о том, что между миром молекул и микроскопически видимых частиц находится область раздробленности вещества с комплексом новых свойств, присущих этой форме организации вещества.
Представим себе кубик какого-либо вещества, который будем разрезать параллельно одной из его плоскостей, затем полученные пластинки начнем нарезать на палочки, а последние — на кубики (рис. 87). В результате такого диспергирования (дробления) вещества получаются пленочно-, волокнисто- и корпускулярнодисперсные (раздробленные) системы. Если толщина пленок, поперечник волокон или частиц (корпускул) меньше разрешающей способности оптического микроскопа, то они не могут быть обнаружены с его помощью. Такие невидимые в оптический микроскоп частицы называют коллоидными, а раздробленное (диспергированное) состояние веществ с размером частиц от 400-300 нм до 1 нм — коллоидным состоянием вещества.
Дисперсные (раздробленные) системы являются гетерогенными. Они состоят из сплошной непрерывной фазы -дисперсионной среды и находящихся в этой среде раздробленных частиц того или иного размера и формы — дисперсной фазы.
Поскольку дисперсная (прерывная) фаза находится в виде отдельных небольших частиц, то дисперсные системы, в отличие от гетерогенных со сплошными фазами, называют микрогетерогенными, а коллоиднодисперсные системы называют также ультра-микрогетерогонными, чтобы подчеркнуть, что в этих системах граница раздела фаз не может быть обнаружена в световом микроскопе.
- 297 -
Когда вещество находится в окружающей среде в виде молекул или ионов, то такие растворы называют истинными, т. е. гомогенными однофазными растворами.
Обязательным условием получения дисперсных систем является взаимная нерастворимость диспергируемого вещества и дисперсионной среды. Например, нельзя получить коллоидные растворы сахара или хлорида натрия в воде, но они могут быть получены в керосине или в бензоле, в которых эти вещества практически нерастворимы.
Дисперсные системы классифицируют по дисперсности, агрегатному состоянию дисперсной фазы и дисперсионной среды, интенсивности взаимодействия между ними, отсутствию или образованию структур в дисперсных системах.
Количественной характеристикой дисперсности (раздробленности) вещества является степень дисперсности (степень раздробленности, D) — величина, обратная размеру (а) дисперсных частиц:
D = 1 / a
Здесь a равно либо диаметру сферических или волокнистых частиц, либо длине ребра кубических частиц, либо толщине пленок.
Степень дисперсности численно равна числу частиц, которые можно плотно уложить в ряд (или в стопку пленок) на протяжении одного сантиметра. В табл. 21 приведены условно принятые границы размеров частиц систем с различной раздробленностью вещества.
Таблица 21. Классификация корпускулярнодисперсных систем по степени дисперсности

Если все частицы дисперсной фазы имеют одинаковые размеры, то такие системы называют монодисперсными (рис. 88, а и б). Частицы дисперсной фазы неодинакового размера образуют пол и дисперсные системы (рис. 88, в).
- 298 -
С повышением дисперсности все большее и большее число атомов вещества находится в поверхностном слое, на границе раздела фаз, по сравнению с их числом внутри объема частиц дисперсной фазы. Соотношение между поверхностью и объемом характеризует удельная поверхность: Sуд = S/V, которая для частиц сферической формы равна
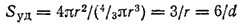
а для частиц кубической формы
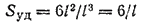
где r — радиус шара; d — его диаметр; l — длина ребра куба.
Так, удельная поверхность вещества, раздробленного до микронных кубиков, составляет 6·104 см-1. При этом из 1 см3 образуется 1012 микронных кубиков с суммарной поверхностью (S = Sуд·V), равной 6·104 см2(6 м2). При дальнейшем дроблении 1 см3 вещества до кубиков коллоидной дисперсности, например С длиной ребра l = 4 см(10 нм), их число достигает 1018 частиц, суммарная поверхность — 6·106 см2 (600 м2), а удельная поверхность — 6·106 см-1.
Следовательно, с повышением дисперсности вещества все большее значение имеют его свойства, определяемые поверхностными явлениями, т. е. совокупностью процессов, происходящих в межфазовой поверхности. Таким образом, своеобразие дисперсных систем определяется большой удельной поверхностью дисперсной фазы и физико-химическим взаимодействием дисперсной фазы и дисперсионной среды на границе раздела фаз.
Многообразие дисперсных систем обусловлено тем, что образующие их фазы могут находиться в любом из трех агрегатных состояний. При схематической записи агрегатного состояния дисперсных систем первым указывают буквами Г (газ), Ж (жидкость) или Т (твердое) агрегатное состояние дисперсионной среды, затем ставят тире и записывают агрегатное состояние дисперсной фазы.
Дисперсные системы с газообразной дисперсионной средой называют аэрозолями. Туманы представляют собой аэрозоли С жидкой дисперсной фазой (Г1 - Ж2), а пыль и дым — аэрозоли с твердой дисперсной фазой (Г1 - Т2); пыль образуется при диспергировании веществ, а дым — при конденсации летучих веществ.
Пены — это дисперсия газа в жидкости (Ж1 - Г2), причем в пенах жидкость вырождается до тонких пленок, разделяющих отдельные пузырьки газа. Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена в другой, нерастворяющей ее жидкости (Ж1 - Ж2). Низкодисперсные системы твердых частиц в жидкостях (Ж1 - Т2) называют суспензиями, или взвесями, а предельно-высокодисперсные — коллоидными растворами, или золями, часто лиозолями, чтобы подчеркнуть, что дисперсионной средой является жидкость (от греч. «лиос» — жидкость).
- 299 -
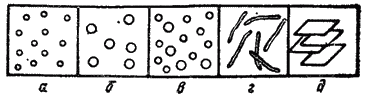
Рис. 88. Свободнодисперсные системы: корпускулярно- (а—в), волокнисто- (г)и пленочно-дисперсные (д); а, 6 — монодисперсные; в — полидисперсная система.
Если дисперсионной средой является вода, то такие золи называют гидрозолями, а если органическая жидкость — органозолями.
В твердой дисперсионной среде могут быть диспергированы газы, жидкости или твердые тела. К системам Т1 - Г2 (твердые пены) относятся пенопласты, пенобетон, пемза, шлак, металлы с включением газов. Как своеобразные твердые пены можно рассматривать и хлебобулочные изделия. В твердых пенах газ находится в виде отдельных замкнутых ячеек, разделенных дисперсионной средой. Примером системы Т1 - Ж2 является натуральный жемчуг, представляющий собой карбонат кальция, в котором коллоидно-диспергирована вода.
Большое практическое значение имеют дисперсные системы типа Т1 - Т2. К ним относятся важнейшие строительные материалы (например, бетон), а также металлокерамические композиции (керметы, стр. 639) и ситаллы (стр. 500),
К дисперсным системам типа Т1 - Т2 относятся также некоторые сплавы, цветные стекла, эмали, ряд минералов, в частности некоторые драгоценные и полудрагоценные камни, многие изверженные горные породы, в которых при застывании магмы выделились кристаллы.
Цветные стекла образуются в результате диспергирования в силикатном стекле примесей металлов или их оксидов, придающих стеклу окраску. Например, рубиновое стекло содержит 0,01—0,1% золота с размером частиц 4—30 мкм. Условия получения ярко-красных рубиновых и других окрашенных стекол изучались еще М. В. Ломоносовым. Эмали — это силикатные стекла с включениями пигментов ( SnO2, TiO2, ZrO2), придающих эмалям непрозрачность и окраску. Драгоценные и полудрагоценные камни часто представляют собой оксиды металлов, диспергированные в глиноземе или кварце (например, рубин — это Cr2O3, диспергированный в Al2O3).
Дисперсные системы могут быть свободнодисперсными (рис. 88) и связнодисперсными (рис. 89, а — б) в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы. К свободнодисперсным системам относятся аэрозоли, лиозоля, разбавленные суспензии и эмульсии. Они текучи. В этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести. Связнодисперсные системы — твердообразны; они возникают при контакте частиц дисперсной фазы, приводящем к образованию структуры в виде каркаса или сетки. Такая структура ограничивает текучесть дисперсной системы и придает ей способность сохранять форму. Подобные структурированные коллоидные системы называют гелями.
- 300 -
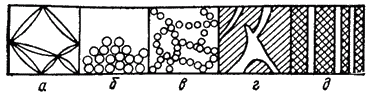
Рис. 89. Связнодисперсные (а — в) и капиллярнодисперсные (г, д) системы: гель (а), коагулят с плотной (б) и рыхлой — «арочной» (в) структурой.
Переход золя в гель, происходящий в результате понижения устойчивости золя, называют гелеобразовапием (или желатинированием). Сильно вытянутая и пленочно-листочковая форма дисперсных частиц повышает вероятность контактов между ними и благоприятствует образованию гелей при малой концентрации дисперсной фазы. Порошки, концентрированные эмульсии и суспензии (пасты), пены — примеры связнодисперсных систем. Почва, образовавшаяся в результате контакта и уплотнения дисперсных частиц почвенных минералов и гумусовых (органических) веществ, также представляет собой связнодисперсную систему.
Сплошную массу вещества могут пронизывать поры и капилляры, образующие капиллярнодисперсные системы (рис. 89, г, д). К ним относятся, например, древесина, разнообразные мембраны и диафрагмы, кожа, бумага, картон, ткани.
| <<< Назад Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ |
Вперед >>> 106. Состояние вещества на границе раздела фаз. |
- 105. Дисперсное состояние вещества.
- 106. Состояние вещества на границе раздела фаз.
- 107. Коллоиды и коллоидные растворы.
- 108. Дисперсионный анализ.
- 109. Сорбция и сорбционные процессы.
- 110. Ионообменная адсорбция.
- 111. Хроматография.
- 112. Электрокинетические явления.
- 113. Устойчивость и коагуляция дисперсных систем.
- 114. Структурообразование в дисперсных системах.
- 106. Состояние вещества на границе раздела фаз.
- Глава IV КРУГОВОРОТ ЖИЗНИ И КРУГОВОРОТ ВЕЩЕСТВА В ПРИРОДЕ
- Микробы вырабатывают красящие вещества
- 5.1. Вредные вещества, поступающие в атмосферу при пожарах
- 3.10. Высота стабилизации вещества выброса
- 5.5. Опасные воздействия и вредные вещества в быту
- 10.2. Геохимическая работа живого вещества
- 9. Органические вещества. Нуклеиновые кислоты
- 2.3.2. Органические вещества клетки. Углеводы, липиды
- 2.3.1. Неорганические вещества клетки
- Вещества органические и неорганические.
- 8. Органические вещества. Углеводы. Белки
