Книга: Эволюция. Классические идеи в свете новых открытий
Откуда взялся новый фермент?
| <<< Назад Секретный код позвоночных выдал ланцетник |
Вперед >>> Обоняние и цветное зрение развивались в противофазе |
Откуда взялся новый фермент?
Амплификация (увеличение числа копий гена; частным случаем амплификации является дупликация — удвоение) с последующим разделением функций между копиями — по-видимому, самый распространенный способ появления новых генов. Мы уже знаем, что новая функция может появиться у одной из копий как до, так и после амплификации. В обоих случаях обязательным этапом является закрепление полезных мутаций в одной или нескольких копиях размножившегося гена. Проблема в том, что полезные мутации должны появиться быстро — до того как избыточные копии гена будут безнадежно испорчены вредными мутациями. Иначе все вернется на круги своя и в геноме снова останется только одна рабочая копия гена плюс некоторое количество «мусора»— поврежденных мутациями псевдогенов (вышедших из строя, неработающих генов), в которые превратятся остальные копии.
Биологи из Швеции и США разработали теоретически (Bergthorsson et al., 2007), а затем и экспериментально подтвердили (N?svall et al., 2012) сценарий появления новых генов, который они назвали ИАД (инновация — амплификация — дивергенция). Сценарий похож на уже знакомый нам уход от адаптивного конфликта, но имеет важное отличие. В сценарии ИАД амплификация сама по себе имеет адаптивный смысл: новообразованные копии гена с самого начала не являются избыточными. Они полезны, и поэтому отбор препятствует их порче. Это дает им время дождаться появления полезных мутаций. Главная хитрость тут в том, что амплификация гена увеличивает производство кодируемого им белка, а это, как правило, усиливает выполнение функций, за которые отвечает белок.
Схема ИАД показана на рисунке. У гена с основной функцией А появляется (или давно существует в качестве «побочного эффекта») дополнительная функция B, которая поначалу осуществляется с низкой эффективностью (и потому обозначается как b). Если эта побочная функция вдруг окажется полезной (например, из-за изменения условий среды), то отбор начнет поддерживать мутации, усиливающие эту функцию. Простейшим способом добиться этой цели, не нарушив функцию А, является амплификация бифункционального гена. Чем больше копий гена будет в геноме, тем больше будет молекул соответствующего белка и тем эффективнее станет осуществляться функция B. Таким образом, отбор будет поддерживать дупликации гена и защищать появляющиеся копии от мутационных повреждений. Заметим, что амплификация генов — весьма распространенная категория мутаций. Например, у бактерии Salmonella enterica, с которой работали исследователи, вероятность дупликации любого гена составляет примерно 10?5 на каждое клеточное деление[72].
Размножившиеся копии гена могут затем специализироваться. Если в одной из копий возникнут мутации, усиливающие функцию B в ущерб A, отбор их поддержит, ведь функция B «в дефиците», а с функцией A успешно справляются другие копии. Позднее у какой-то из них функция А может дополнительно оптимизироваться — возможно, за счет утраты функции B.
После появления генов-«специалистов», оптимизированных для функций или A или B, остальные копии станут действительно лишними. Скорее всего, они рано или поздно будут испорчены и превратятся в псевдогены или будут утрачены.
Для проверки своих идей ученые поставили эволюционный эксперимент на сальмонеллах. Для начала они взяли бактерий с удаленным геном trpF. Фермент, кодируемый этим геном, катализирует один этап синтеза аминокислоты триптофана. Тот же этап в синтезе другой аминокислоты, гистидина, катализируется ферментом hisA.
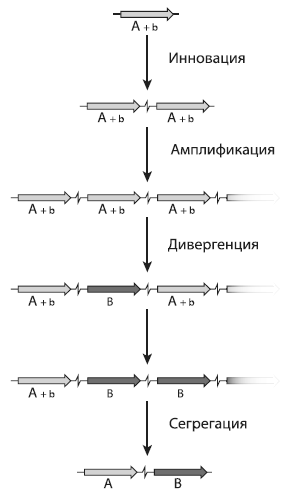
Образование нового гена по схеме «инновация — амплификация — дивергенция». Пояснения в тексте. Из N?svall et al., 2012.
Выращивая сальмонелл, лишенных trpF, в среде без триптофана, авторы обнаружили и отобрали сальмонелл-мутантов, у которых синтез триптофана взял на себя hisA. Для этого сальмонеллам пришлось немного подпортить мутациями свой hisA — удвоить три кодона и заменить еще один. В результате фермент hisA стал бифункциональным. Он приобрел способность выполнять функцию trpF, хоть и с низкой эффективностью[73]. Исходная функция hisA при этом тоже пострадала: синтез гистидина стал менее эффективным. Но все же бактерии-мутанты могли теперь выжить в среде, не содержащей ни триптофана, ни гистидина. Таким образом, возникшую мутацию можно рассматривать как первый этап — инновацию в сценарии ИАД. Удастся ли подопытным микробам пройти остальные два этапа?
Бактерий-мутантов, разделенных на несколько линий, выращивали в среде без триптофана и гистидина. Чтобы отслеживать генные дупликации, рядом с hisA поместили ген желтого флюоресцирующего белка, так что о количестве копий данного фрагмента генома можно было судить по силе флюоресценции.
Поскольку мутантный фермент hisA обе свои функции выполнял плохо, поначалу бактерии росли медленно. Однако уже через несколько сотен поколений скорость размножения бактерий во многих линиях увеличилась. Это произошло за счет амплификации бифункционального гена. В некоторых линиях появилось до 20 копий hisA. В результате количество производимого фермента увеличилось, и обе аминокислоты стали синтезироваться быстрее. Таким образом, второй этап сценария — амплификация — тоже подтвердился.
Эксперимент продолжался 3 тыс. поколений. За это время мутации, ускоряющие рост, закрепились во всех линиях. При этом в большинстве линий произошла дивергенция: появились ферменты-«специалисты», эффективно выполняющие одну из двух функций. Иногда это сопровождалось потерей лишних копий (две копии становились «специалистами», остальные терялись). Все это соответствует предсказаниям модели ИАД. Но было обнаружено и кое-что неожиданное: в некоторых линиях под действием мутаций и отбора сформировался фермент-«генералист», хорошо справляющийся с обеими функциями одновременно!
Эксперимент показал, что сценарий «инновация — амплификация — дивергенция» реалистичен. Не исключено, что многие новые гены в ходе эволюции возникали именно таким путем.
| <<< Назад Секретный код позвоночных выдал ланцетник |
Вперед >>> Обоняние и цветное зрение развивались в противофазе |
- Изменения белок-кодирующих генов
- Изменения регуляции генов
- Дупликация генов
- Секретный код позвоночных выдал ланцетник
- Откуда взялся новый фермент?
- Обоняние и цветное зрение развивались в противофазе
- Новые белки из старого конструктора
- Горизонтальный перенос генов и симбиоз
- Горький привкус победы, или Как дрожжи заплатили за успех
- Бактерии наследуют приобретенный иммунитет
- Бактериальные гены помогли нематодам стать паразитами
- Сельскохозяйственные симбиозы
- 26. Новый способ лечения психических заболеваний
- Новый человек
- Н. Д. Оводов Плейстоценовый снежный баран Сибири
- Дивный новый мир вирусов и прокариот
- ПОХОДНЫЙ СОСНОВЫЙ ШЕЛКОПРЯД
- Большой сосновый долгоносик (Hylobius abietis L.)
- 674. Какие хищники могут проникнуть в Атлантический океан через новый Панамский канал?
- 719. Что такое рыбный протеиновый концентрат (РПК)?
- Новый Шанхай – Пудун
- 620. Что представляет собой «терновый венец»?
- 722. Почему рыбный протеиновый концентрат изготовляют из неразделенной рыбы?
- НОВЫЙ ТЕЛЕСКОП
