Книга: Таинственный геном человека
13. Рычаги управления
| <<< Назад 12. Эволюция на геномном уровне |
Вперед >>> 14. История, хранящаяся в ДНК |
13. Рычаги управления
Мы очень много обсуждали ДНК, потому что я приехал в Оксфорд всего с парой идей, и обе они оказались наполовину неправильными.
Новый этап открытий начался еще в 1991 году с работы американских биологов Виктора Эмброса, Розалинд Ли и Ронды Фейнбаум, которые исследовали ген lin -14, регулирующий развитие червя C. elegans. Как вы, возможно, помните, именно этот крошечный червь был выбран для проведения экспериментов другом и коллегой Крика Сидни Бреннером в одном из первых экспериментов с генами и молекулярной биологией развития. Возможно, вы также припоминаете, как этот червь оказался настолько полезным для Бреннера и его коллег, что впоследствии превратился в подопытное животное для тысяч лабораторных экспериментов по всему миру. Труды Бреннера были продолжены биологами Робертом Хорвицем из США и Джоном Салстоном из Англии, которые в 2002 году получили Нобелевскую премию по физиологии и медицине за открытие «генетической регуляции развития органов и запрограммированной смерти клеток».
Выделение курсивом сделал я, так как хотел обратить ваше внимание на то, что могут означать эти слова.
В организме взрослого человека каждый день в процессе деления, или митоза, появляются триллионы новых клеток. При каждом делении клетки копируется весь геном. Одновременно с этим то же количество клеток умирает в процессе контролируемого суицида, который называется запрограммированной смертью клеток, или апоптозом. Если задуматься, то смерть, как и жизнь, оказывается вписанной в наш геном, и работа Бреннера помогла впервые понять генетику смерти. В эту более темную сторону генетического программирования вовлечены специальные регуляторные гены и генетические пути, а еще — РНК, странная сестра ДНК, Золушка среди нуклеиновых кислот.
Ряд крошечных молекул РНК длиной в 20–30 нуклеотидов был открыт еще в 1991 году, но ученые не могли с уверенностью оценить важность этого открытия. Через несколько лет проживающий в Великобритании ботаник Дэвид Боулкомб совместно со своим коллегой Эндрю Хэмилтоном обнаружил, что небольшие интерактивные молекулы РНК или миРНК способны каким-то образом отключать молекулы информационной РНК. Два генетика из США, Крейг К. Мелло и Эндрю З. Файер, решили исследовать этот механизм более детально на примере C. elegans. Они сфокусировались на генетическом контроле мышечного белка, необходимого для нормального движения червя, ввели в гонады молекулы миРНК и стали наблюдать, как это повлияет на динамику движений. Для начала они разделили миРНК на две нити — смысловую и антисмысловую. Первой в тестировании была использована смысловая нить — та, которая точно соответствовала оригинальному коду ДНК. Ни одна из нитей не оказала никакого воздействия на движения червя. Только когда обе нити были введены вместе, стал заметен определенный эффект. Червь начал дергаться неестественным образом. Точно такое же нарушенное движение наблюдалось, когда соответствующий ген оказывался поражен мутацией.
Потрясенные ученые осознали, что крошечные молекулы миРНК умеют отключать определенные информационные РНК. Иными словами, даже после того, как трансляция уже произошла, то есть информационная РНК была скопирована с гена, интроны удалены, а экзоны соединены вместе и готовая молекула РНК уже готова попасть в цитоплазму и кодировать белок, молекулы миРНК могут остановить процесс.
Теперь, по прошествии времени, мы понимаем, почему шведские ученые считали необходимым рассматривать вирусные белки не только как транскрипты информационной РНК, но и как экспрессированные белки в клетках.
Этот эпигенетический механизм называется РНК-интерференцией, которая представляет собой еще один способ эпигенетического контроля. Выводы из этого открытия казались невероятными. РНК-интерференция распознает ключевые последовательности в определенных молекулах информационных РНК, чтобы дезактивировать их или полностью уничтожить. В 2006 году Файер и Мелло получили за это открытие Нобелевскую премию по физиологии и медицине.
С самых первых дней ученые действовали на основании догмата о том, что гены кодируют строго определенные белки. Затем выяснилось, что для этого требуются молекулы информационной РНК — иРНК. Другой тип РНК, транспортная, или тРНК, необходим для транспорта аминокислот в рибосомы, а третий, являющийся частью базовой структуры рибосом (рибосомальная РНК), считывает информацию с иРНК и превращает код в белок. Однако в начале существования генетики эти роли считались вторичными или, по крайней мере, промежуточными и не такими важными, как благородная центральная парадигма «ген — белок». Но теперь ученые узнали о четвертом типе РНК, РНК-интерференции — молекулярном выключателе! Разумеется, все три типа РНК, кроме информационной, должны кодироваться в хромосомах с помощью последовательностей ДНК. Но эти кодирующие области сложно назвать генами. Раз их конечным продуктом являются РНК-молекулы, значит, они не кодируют белки.
Генетики столкнулись с дилеммой. Как именно следует классифицировать генетические последовательности, кодирующие РНК? Кроме того, после открытия РНК-интерференции ряд других мелких «некодирующих» РНК тоже ставили парадигму под сомнение.
Некоторые предлагали концепцию РНК-гена, то есть гена, кодирующего РНК, но у других имелись сомнения на этот счет. Однако, как бы там ни было с терминологической точки зрения, не оставалось сомнений, что человеческий геном содержит коды большого количества разнообразных РНК-молекул, которые не кодируют белки, но тем не менее играют существенную роль в контроле и экспрессии генов.
Ингибирование РНК небольшими, некодирующими двойными молекулами РНК имело не только теоретическое значение, но и практическую важность для биологов и генетиков. Теперь они могли изучать роль того или иного гена, наблюдая за тем, что произойдет с клеткой или живым организмом после его «выключения». Эта технология имеет огромный медицинский потенциал. Например, некоторые женщины наследуют мутации генов BRCA1 или BRCA2, отвечающие за развитие рака груди или яичников. У других пациентов рано развиваются симптомы болезни Хантингтона. Теоретически, для того чтобы избавить этих людей от мучений, можно всего лишь отключить соответствующий мутировавший ген. В будущем, а возможно даже раньше, чем мы предполагаем, генетики научатся это делать.
Кроме того, РНК-интерференция — это не единственный способ влияния РНК на регулирование генов. Группа небольших некодирующих РНК, называемых piРНК, играет важную роль в эпигенетическом подавлении опасных вирусных последовательностей в человеческом геноме. Более того, существует еще один, даже более интересный, класс некодирующих РНК, который регулирует человеческий геном. Это сравнительно недавнее открытие, объясняющее черную дыру, существовавшую в проекте расшифровки генома 2001 года, — те 50 %, которые были пустыми.
* * *
У всех млекопитающих имеется половая дифференциация хромосом — X и Y. Женщины наследуют от каждого из родителей по одной Х-хромосоме, а мужчины — Х от матери и Y от отца. Кроме того, мы получаем от каждого из родителей по 22 неполовые хромосомы, называемые аутосомами. В итоге формируется ядерный геном из 46 хромосом. В то время как Y-хромосома содержит 78 генов, кодирующих белок и в основном отвечающих за образование яичек, мужское телосложение, фертильность и производство спермы, Х-хромосома насчитывает около 2000 генов, лишь отдельные из которых имеют отношение к полу. Такое хромосомное несоответствие между полами ведет к потенциальному дисбалансу в регулировании эмбриологического развития. Если бы половые хромосомы были полностью экспрессированы во время эмбриогенеза, эмбрионы женского пола (как и женщины в течение всей жизни) получали бы двойную дозу генов Х-хромосомы, а эмбрионы мужского пола (и мужчины) — одинарную. Это могло бы привести к существенным регуляторным проблемам.
В 1961 году Мэри Ф. Лайон, бывшая ученица пионера эпигенетики Конрада Х. Уоддингтона, поняла, что разгадка может заключаться в отключении одной из Х-хромосом у женщин. Ее идея подтвердилась, когда генетики доказали, что «Х-инактивация» у эмбрионов женского пола происходит примерно на 16-й день развития. Удивительно, что при этом не выбирается Х-хромосома определенного родителя. Инактивация случайным образом касается либо отцовской, либо материнской Х-хромосомы. Кроме того, отключается не вся хромосома, а около 60 % ее генов. Оставшиеся 40 % необходимы для защиты эмбриона от рецессивной мутации по Х-хромосоме. Вот почему у женщин почти не бывает цветовой слепоты или гемофилии. Им бы понадобилась двойная доза мутировавших рецессивных генов, в то время как мужчинам хватает одной копии, содержащейся в Х-хромосоме.
В 1991 году, почти через 30 лет после того, как Лайон пришла в голову идея инактивации, ученые из Стэнфордского университета выяснили, что один ген в инактивированной Х-хромосоме играет ключевую роль в процессе ее отключения. Этот ген назвали Xist, что расшифровывается как X inactive specific transcript. Ученые также предположили, что он должен действовать путем трансляции в соответствующий Xist — белок. Но его поиски ни к чему не привели. Это было удивительно, ведь они могли отследить экспрессию гена в соответствующую информационную РНК, которая проходила сплайсинг для удаления интронов и экзонов, соединенных друг с другом традиционным образом. Однако после этого иРНК не перемещалась в рибосомы для производства белка. Кажется, пришло время снова сесть на наш волшебный поезд, чтобы воочию понаблюдать за одним из самых поразительных недавних открытий в области человеческого генома. Мы въезжаем в волшебную страну, и я направляю поезд по одному из двух одинаковых путей — Х-хромосом. Мы попали в геном эмбриона женского пола в критический 16-й день эмбриогенеза.
Мы видим, как делятся клетки эмбриона и копируется геном. Рельсы нашего пути расходятся, разрываются слабые водородные связи между шпалами, и смысловая нить ДНК отделяется от антисмысловой. Скорость копирования потрясает. Надвигается метель, но вместо снежинок в ней нуклеотиды РНК — Г, А, Ц и У. На наших глазах некоторые участки смысловой нити начинают светиться разными цветами. Одни из них обозначают гены, другие — промоторы, третьи — вирусные участки, а четвертые — участки, о которых мы пока ничего не знаем. Этот процесс очень похож на кодирование белка, которое мы уже видели и при котором нить ДНК копируется на нить информационной РНК. Но здесь, судя по всему, копирование не прекращается и захватывает несколько тысяч нуклеотидов, составляющих примерно один ген. Формируется огромная молекула РНК, состоящая из 17 тысяч нуклеотидов. Судя по всему, она имеет необычную внутреннюю структуру, в которой присутствуют генетические эквиваленты точек, или стоп-кодоны. До этого мы не видели ничего подобного.
— Что это такое?
— Это длинная некодирующая РНК, результат работы того, что некоторые генетики называют РНК-геном. Научное название для нее — Xist — РНК.
Мы наблюдаем, как молекула РНК проплывает над Х-хромосомой, изменяя эпигенетические маркеры активирующих гены гистонов таким образом, что группы гистонов превращаются в плотные некодирующие формации, и собирая вокруг себя облачка белков для метилирования пар Ц — Г.
— Что происходит?
— Она отключает хромосому, но не целиком, а лишь на 60 %.
Xist был признан первым из нового удивительного класса эпигенетических контролирующих механизмов, которые мы сегодня называем длинными некодирующими РНК, или днРНК. Вскоре после этого была открыта еще одна днРНК, которая объяснила важную эпигенетическую загадку.
Генетики уже знали, что геном может распознавать происхождение хромосом из пары. Иными словами, он может выбирать отцовскую или материнскую хромосому при экспрессии определенного гена или группы генов. Эпигенетический механизм, который называется импринтингом, является ключевым фактором в развитии таких генетических заболеваний, как синдромы Прадера — Вилли или Ангельмана, потому что он выбирает поврежденную хромосому, полученную от одного из родителей, в то время как парная ей может быть абсолютно здоровой. Генетики выяснили, что основным механизмом действия импринтинга является эпигенетическое отключение определенной области второй (не выбранной) хромосомы с помощью длинной некодирующей РНК, получившей название Air.
Вдохновленные этими открытиями, ученые начали искать другие длинные некодирующие РНК и выяснили, что они вписаны в различные участки генома млекопитающих. Со временем днРНК были признаны частью недавно открытой и очень мощной эпигенетической регуляторной системы, что дало толчок новым исследованиям, которые ведутся и сейчас, пока я пишу эту книгу. Мы уже знаем, что человеческий геном, как и геном растений и животных, содержит множество длинных и коротких некодирующих РНК, среди которых днРНК длиной от 200 до 100 тысяч нуклеотидов выделяются в отдельный класс. То, что мы знаем о кодировании таких днРНК, на первый взгляд кажется необычным, но при этом поразительно логичным.
Существует второй, совершенно новый вариант считывания всего генома. Этот вариант затрагивает обычные границы генов или регуляторных последовательностей. В таком случае можно кодировать любую последовательность, входящую в состав экзона, группы экзонов, промоторного региона, или комбинации промотора и экзона, или регуляторного длинного кольцевого повтора вируса, или всего этого вместе. В результате транскипции возникают некодирующие молекулы РНК.
Вот вам и объяснение неизвестных 50 % генома.
Я вижу удивление на вашем лице. Мы все еще находимся на волшебном поезде, направляясь в обычный мир.
— Загадка состояла в том, как именно получались такие геномные последовательности. При прочтении генома в 2001 году все последовательности информационных РНК, обнаруженные в человеческой клетке, компилировались с помощью технологии, носящей название маркерных экспрессируемых последовательностей. Информационная РНК реверсировалась до ее комплементарной ДНК, или кДНК, поэтому схема 2001 года основывалась не на ДНК человеческого генома, а на совокупности кодов всех информационных РНК, экспрессированных из ДНК.
Вы все еще качаете головой.
— Когда речь идет о генетических последовательностях, геном или большая его часть на самом деле транслируется дважды — двумя совершенно разными способами…
— Ага, то есть весь геном копируется два раза.
— Точно. Вот почему черная дыра составляла 50 %. В ней не хватало второй трансляции в некодирующие РНК.
* * *
Теперь мы видим, как старый подход к геному, в котором основное внимание уделялось генам ДНК, кодирующим белки, мешал нам увидеть всю картину целиком. Это более комплексное понимание все еще подвергается оценке специалистов.
Номенклатура некодирующих РНК проста и предсказуема — они называются в честь кодирующей их последовательности генома. Последовательность, основанная на одном экзоне или интроне, называется экзонной или интронной днРНК, на гене — генной днРНК и т. д. Может быть получена днРНК из смысловой нити ДНК, из промоторной последовательности, из целого гена, включая все экзоны и интроны, или даже из промежуточных последовательностей между различными генами, включая регуляторные области. Кроме того, таким же образом она может кодироваться и антисмысловой нитью ДНК. Некоторые кодируются в обоих направлениях и называются двунаправленными транскриптами. Существуют даже митохондриальные днРНК и вирусные или LINE — и SINE — ассоциированные РНК, которые коллективно называются днРНК, ассоциированными с повторами. Их цель состоит в эпигенетическом контроле генома, и, как можно понять из их невероятного репертуара, они отвечают за множество геномных функций.
Одна из таких функций — взаимодействие с так называемыми регуляторными белками, то есть белками, которые включают и выключают гены. К нити ДНК в определенной точке присоединяется днРНК, захватывает регуляторный белок и переносит его туда, где он должен находиться, чтобы влиять на соответствующий ген. И хотя исследования в этой области все еще ведутся, мы уже знаем, что днРНК участвует в эпигенетической, генетической и геномной регуляции различных, порой очень сложных биологических процессов. Они имеют значение на эмбриональном этапе развития, где играют важную роль в стволовых клетках эмбриона — плюрипотентных клетках, из которых он полностью состоит на ранней стадии. Участвуют днРНК и в дифференциации стволовых клеток, которая затем ведет к появлению различных органов и тканей. Как мы уже видели в случае синдромов Прадера — Вилли и Ангельмана, они играют важную роль в наследственных аспектах некоторых заболеваний обмена веществ. Кроме того, они имеют отношение к развитию рака груди, мочевого пузыря, прямой кишки, простаты, легких, костей, мозга, меланомы и лейкемии. Также существует мнение, что днРНК могут влиять на развитие аутоиммунных заболеваний, ишемической болезни сердца, неврологических заболеваний, таких как спинально-церебеллярная атаксия, синдром Мартина — Белл, болезнь Альцгеймера и, вероятно, на процесс старения.
Теперь мы можем заполнить пробелы и составить новую схему генома (приведена диаграмма человеческого генома на 2012 год).
Разбивка человеческого генома по ДНК
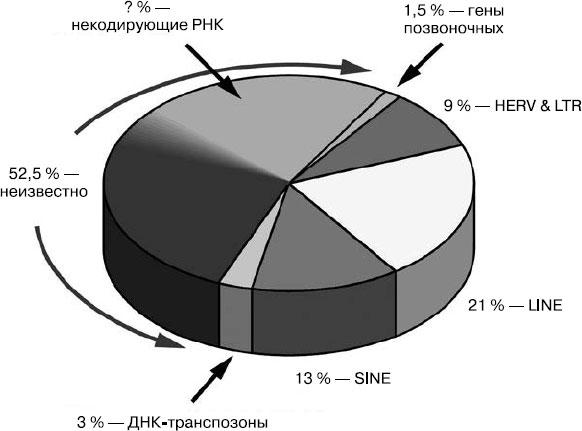
Какой невероятной сложностью обладает структура, лежащая в основе нашего существования! Различные генетические единицы не расположены в разных частях генома группами, как мы видим на схеме, а разбросаны по нему так, что гены вирусов и позвоночных перемешиваются, а ДНК, которая транслируется в некодирующую РНК, игнорирует возможные функции других кодирующих последовательностей и втирается между ними. Пестрые разнообразные структуры идут друг за другом в хромосомах, а порой сидят друг у друга на головах. В этом потрясающе запутанном резервуаре наследственности спрятана тайна человеческой истории от наших самых далеких предков, еще даже не похожих на людей, и до сегодняшнего дня.
А теперь я предлагаю отправиться навстречу новым загадкам.
| <<< Назад 12. Эволюция на геномном уровне |
Вперед >>> 14. История, хранящаяся в ДНК |
- Введение
- 1. Кто бы мог подумать?
- 2. ДНК оказывается кодом
- 3. История на картинке
- 4. Парочка неудачников
- 5. Тайна жизни
- 6. Родственная молекула
- 7. Следующий логический шаг
- 8. Первые наброски человеческого генома
- 9. Как изменяется наследственность
- 10. Преимущества совместной жизни
- 11. Вирусы среди нас
- 12. Эволюция на геномном уровне
- 13. Рычаги управления
- 14. История, хранящаяся в ДНК
- 15. Наши более далекие предки
- 16. Великие доисторические дебри
- 17. Родственники человека
- 18. Судьба неандертальцев
- 19. То, что делает нас уникальными
- 20. Пятый элемент
- Список литературы
- Благодарности
- Содержание книги
- Популярные страницы
- Кибернетика – наука о принципах управления
- 7.4. Физиологические основы управления тренировочным процессом с учетом функциональной асимметрии
- 6.1.1. общая схема управления движениями
- 7.11. Согласования органов местного самоуправления
- 2.6.1. Возрастные особенности управления движениями
- Ротшильды и искусство управления деньгами
- § 3. Легальное господство: чистый тип с бюрократическим штабом управления
- § 14. Порядки управления и регулирования
