Книга: Естествознание. Базовый уровень. 10 класс
Построение структурных формул. Углеводороды.
| <<< Назад § 54 Строение и свойства органических веществ |
Вперед >>> Углеводы. |
Построение структурных формул. Углеводороды.
На основе этих идей А. М. Бутлеров разработал принципы построения графических формул химических веществ. Для этого требуется знать валентность каждого элемента, которую изображают на рисунке в виде соответствующего числа чёрточек. Пользуясь этим правилом, легко установить, возможно или невозможно существование вещества с определённой формулой. Так, существует соединение, называемое метаном и имеющее формулу СН4. Соединение с формулой СН5 невозможно, так как для пятого водорода у углерода уже не найдётся свободной валентности.
Рассмотрим сначала принципы строения наиболее просто устроенных органических соединений. Их называют углеводородами, так как в их состав входят только атомы углерода и водорода (рис. 138). Самым простым из них является упомянутый метан, в котором есть всего один атом углерода. Прибавим к нему ещё один такой же атом и посмотрим, как будет выглядеть молекула вещества, называемого этаном. У каждого атома углерода одна валентность занята его собратом – другим углеродным атомом. Теперь надо заполнить водородом оставшиеся валентности. У каждого атома осталась по три свободных валентных связи, к которым и присоединим по одному атому водорода. Получилось вещество, имеющее формулу С2Н6. Прибавим к нему ещё один атом углерода.
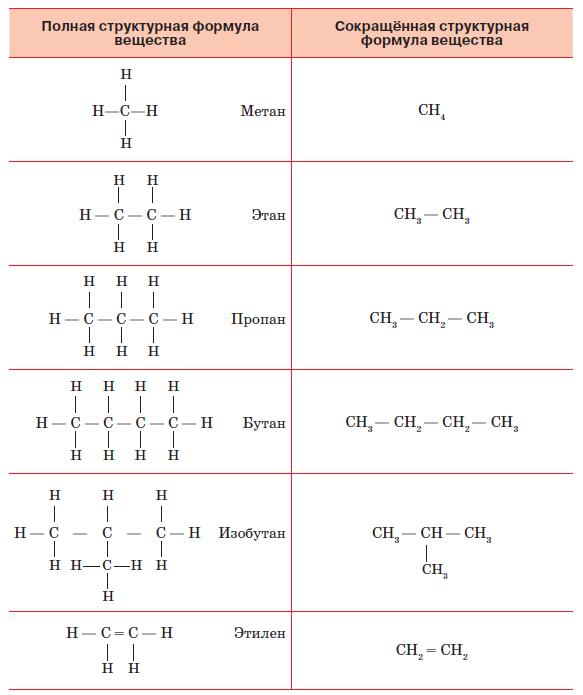
Рис. 138. Полные и сокращённые структурные формулы органических соединений
Теперь мы видим, что у среднего атома осталось только две свободных валентности. К ним мы присоединим по атому водорода. А к крайним углеродным атомам добавим, как и прежде, по три атома водорода. Получим пропан – соединение с формулой С3Н8. Такую цепочку можно продолжать, получая всё новые и новые углеводороды.
Но углеродные атомы необязательно должны располагаться в молекуле в линейном порядке. Допустим, что мы хотим добавить к пропану ещё один углеродный атом. Оказывается, это можно сделать двумя способами: присоединить его либо к крайнему, либо к среднему атому углерода пропана. В первом случае мы получим бутан с формулой С4Н10. Во втором случае общая, так называемая эмпирическая, формула будет такой же, но изображение на рисунке, называемое структурной формулой, будет выглядеть иначе. И название вещества будет несколько иное: не бутан, а изобутан.
Вещества, имеющие одну и ту же эмпирическую, но разные структурные формулы, называют изомерами, а способность вещества существовать в виде различных изомеров – изомерией. Мы, например, употребляем в пищу различные вещества, имеющие одну и ту же формулу С6 Н12О6, но структурные формулы они имеют различные и носят разные названия: глюкоза, фруктоза или галактоза.
Углеводороды, которые мы рассмотрели, называют предельными. В них все атомы углерода связаны между собой одинарной связью. Но так как атом углерода четырёхвалентен и имеет четыре валентных электрона, то теоретически он может образовывать двойные, тройные и даже четверные связи. Четверные связи между атомами углерода в природе не существуют, тройные встречаются редко, а вот двойные присутствуют во многих органических веществах, в том числе и в углеводородах. Соединения, в которых имеются двойные или тройные связи между атомами углерода, называют непредельными или ненасыщенными углеводородами. Возьмём снова молекулу углеводорода, содержащую два атома углерода, но соединим их с помощью двойной связи (см. рис. 138). Мы видим, что теперь у каждого атома углерода осталось по две свободных связи, к каждой из которых он может присоединить по одному атому водорода. Получаемое соединение имеет формулу С2Н4 и называется этиленом. Этилен, в отличие от этана, имеет меньше атомов водорода при том же числе углеродных атомов. Поэтому углеводороды, имеющие двойную связь, и называют ненасыщенными в том смысле, что они не насыщены водородом.
Если углеводород потеряет один атом водорода, у него образуется свободная валентная связь, с помощью которой он может присоединиться к какой-нибудь другой молекуле. Такие остатки углеводородов называют алкилами. Их названия происходят от имени образовавшего их углеводорода с заменой суффикса – ан на – ил (метил, этил, пропил, бутил и т. д.).
Зная принципы строения углеводородов, можно легко понять общие закономерности строения других органических веществ.
| <<< Назад § 54 Строение и свойства органических веществ |
Вперед >>> Углеводы. |
